Изменение - энтальпие
Cтраница 1
Изменения энтальпий ДЯХ и ЛЯ2 были определены с использованием литературных данных по теплоемкостям NH3, CO2 и растворов УАС. [1]
Тогда изменение относительных энтальпий, т.е. процесс в сушильной камере, окончательно выразится соотношениями - на 1 кг уд. [2]
 |
Изменение энтальпии 298 15 - 85 02 для HF CO2 и OF2. [3] |
Значения изменений энтальпий ( Я 298 15 - Я0) и ( Я ткип - Я0) приведены в таблице 2.4 со ссылками на литературу. [4]
Определение изменения энтальпий материальных потоков для неидеальных систем осложняется наличием теплового эффекта при смешении компонентов и неаддитивностью теплоемкости жидкости. Наиболее существенно влияние теплот смешения, данные по которым часто отсутствуют. [5]
Рассмотрение характера изменения энтальпий атомизации в группах солей, образующих изокатионные ряды, позволяет оценивать энтальпии атомизации и рассчитывать энтальпии образования не исследованных еще газообразных солей и корректировать полученные экспериментальные данные, выходящие за пределы линейной зависимости. Работоспособность предложенного критерия термической устойчивости газообразных солей и метода оценки их энтальпий атомизации и образования подтверждена экспериментально на десятках примеров. [6]
Для учета изменения энтальпий материальных потоков по высоте колонны для экстрактивной ректификации предложено [327] рассчитывать процесс с помощью диаграммы энтальпия - состав. [7]
Показано, что изменение энтальпий образования в ряду: пероксид-триоксид-тетраоксид - не носит линейного характера вследствие дополнительной стабилизации пероксидов за счет диполъ-дипольного взаимодействия алкоксигрупп. Таким образом, величина вклада группы [ О - ( О) 2 ] может быть рассчитана в виде разности энтальпий образования три - и тетраоксидов, содержащих идентичные заместители. [8]
Приведены расчетные значения изменения энтальпий при деструкции органических веществ, загрязняющих сточные воды производства акрилатов, а также значения химического потребления кислорода ( ХПК) литром воды, содержащим моль каждого из органических веществ. Предложена формула для расчета с точностью 8 % эндотермического теплового эффекта процесса очистки сточных вод акрмлатных производств на никель-хромовом катализаторе ИГ АИ УССР. [9]
Приведены расчетные значения изменения энтальпий при деструкции органических веществ, загрязняющих сточные воды производства акрилатов, а также значения химического потребления кислорода ( ХПК) литром воды, содержащим моль каждого из органических веществ. Предложена формула для расчета с точностью 8 % эндотермического теплового эффекта процесса очистки сточных вод акрилатных производств на никель-хромовом катализаторе ИГ АН УССР. [10]
Учитывая своеобразный характер изменения энтальпий вблизи критического состояния, возникает вопрос и об изменении величины холодильного коэффициента углекислотного цикла, совершаемого при высокой температуре охлаждающей воды и любом высоком давлении в холодильнике. Действительно, путем соответствующих подсчетов можно показать, что цикл, совершаемый в условиях постоянных температур агента при кипении и перед регулирующим вентилем, но с изменяющимися давлениями в холодильнике, имеет максимальный холодильный коэффициент. [11]
При обсуждении закономерностей изменения энтальпий образования соединений переходных элементов с порядковыми номерами последних очень часто исходят из тех электронных конфигураций атомов d - элементов, которые формально вытекают из состава соединений. Так, рассматривая соединения типа МЭ, где Э - двухвалент-ный элемент, стараются объяснить многие свойства ( в том числе и теплоты образования) на основе представления о том, что с атома переходного элемента делокализовано два электрона. [12]
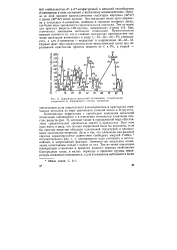 |
Зависимость энтальпий атомизации гомоатомных соединений от порядкового номера элементов. [13] |
Качественная корреляция с характером изменения энтальпий атомизации наблюдается и в изменении температур плавления простых веществ ( рис. 7), которые также в определенной мере обусловлены сравнительной прочностью связей в кристаллах. При этом надо иметь в виду, что полная корреляция была бы возможна, если бы простые вещества обладали одинаковой структурой и одинаковыми значениями энтропии. Значения же энтальпии атомизации сопоставимы только с одним из них. [14]
Качественная корреляция с характером изменения энтальпий атомизации наблюдается и в изменении температур плавления простых веществ ( рис. 124), которые также в определенной мере обусловлены сравнительной прочностью связей в кристаллах. При этом надо иметь в виду, что полная корреляция была бы возможна, если бы простые вещества обладали одинаковой структурой и одинаковыми значениями энтропии. Дело в том, что плавление как фазовый переход характеризуется равенством свободных энергий Гиббса сосуществующих фаз, т.е. одновременно надо учитывать и энтальпийный и энтропийный факторы. Значения же энтальпии атомизации сопоставимы только с одним из них. Тем не менее наинизшие температуры плавления в пределах каждого периода свойственны благородным газам, в пределах главных подгрупп температуры плавления понижаются, а для rf - элементов наблюдается более сложная зависимость. В начале и конце вставных деках ( Sc - Y - La и Zn - Cd - Hg) сверху вниз температуры плавления уменьшаются, а в середине ( Сг - Mo - W) возрастают. [15]
Страницы: 1 2 3 4