Использование - термодинамическая функция
Cтраница 1
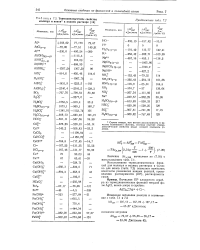 |
Термодинамические свойства молекул и ионов в водном растворе. [1] |
Использование термодинамических функций для молекул в водных растворах и условно для ионов ( табл. 7.2) позволяет вычислять константы равновесия ионных реакций, произведения растворимости ( ПР), растворимость газов. [2]
Использование термодинамических функций позволяет ьслу-чить новые выражения и исследовать критерии равновесия в различных условиях. [3]
Использование термодинамических функций межмолекулярного взаимодействия для предсказания селективности БРА сталкивается с трудностями расчета избыточных частичных ( парциальных) функций взаимодействия в трехкомлонентных смесях, так как термодинамика межмолекуляриого взаимодействуя многокомпонентных систем до сих пор не получила достаточного развития. [4]
Использование термодинамических функций межмолекулярного взаимодействия позволило получить зависимость селективности БРА от значений полных мольных избыточных функций взаимодействия в тройных системах 1 - й компонент - БРА и 2 - й компонент - БРА, где 1 - й и 2 - й компонент - компоненты исходной смеси. [5]
При использовании термодинамических функций состояния нужно удостовериться, применимы ли они к субмикроскопическим объемам. Следует обратить внимание на то, что эти функции состояния нельзя просто перенести на микросистемы. Функции состояния для макроскопических систем могут сильно отклоняться от функций для субмикроскопических зон. [6]
Таким образом, с помощью использования термодинамических функций и свойств открытой системы удается проанализировать работу всех основных типов тепловых машин. [7]
Вычисление вероятности кристаллизации фаз основано на использовании термодинамических функций. [8]
Это значение совпадает с полученным Эйзенштадтом, Ротбергом и Кушем [1472] по второму закону термодинамики и пересчитанным к 0 К с использованием термодинамических функций, принятых в Справочнике. [9]
Раффом и Ли с использованием первого метода, значительно отличается от величин & Hr 2at, рассчитанных для каждой из температур с использованием известных термодинамических функций участвующих в реакции веществ. [10]
Отсутствие подробного рассмотрения ЯУТ-соотношений ( уравнение состояния) для чистых газов и жидкостей и соотношений PVT-состав для растворов может показаться упущением, однако этот раздел исключен потому, что подробное изложение указанных соотношений для чистых веществ дается во многих книгах, а для многокомпонентных систем оно еще до сих пор носит в значительной степени эмпирический характер. В то же время в разных местах текста рассматривается ряд задач, включающих применение различных уравнений состояния и использование термодинамических функций, выраженных в параметрической форме через приведенные давления и температуры. [11]
Однако в приведенном выше определении парциальной мольной величины нет какого-либо ограничения, связанного с фазовым состоянием термодинамической системы: числа молей, интегральные функции и приращения этих величин имеют ясный физический смысл. Поэтому равенство ( 1) формально можно применить для определения парциальных свойств t - того компонента и в гомогенном растворе, и в гетерогенной смеси. Такое расширение обычной области использования парциальных термодинамических функций позволяет рассматривать многофазные смеси как самостоятельные термодинамические системы с присущими им ( а не фазам, составляющим смесь) свойствами. Этот подход оправдан, во-первых, своеобразием свойств гетерогенных смесей. Например, в отличие от однофазных систем, их теплоемкость может быть бесконечно большой, а давление насыщенного пара может уменьшаться с ростом температуры. Во-вторых, методы термодинамики растворов в настоящее время широко применяются для исследования систем, в которых многофазные смеси являются неотъемлемой составной частью либо даже единственным объектом экспериментального изучения. [12]
Пересчет результатов этих опытов с использованием термодинамических функций, принятых в настоящем Справочнике, приводит к близкому значению 171 2 ккал / моль, которому соответствует ДЯ / 0 ( А1Р, газ) - 61 4 1 ккал / моль. [13]
Страницы: 1