Кальций
Cтраница 1
Кальций выделяют ионообменной хроматографией [1436], осаждением на носителе ( гидроокись олова) [357] или осаждением в виде оксалата и пр. [1]
Кальций определяют по его спектральным линиям при 3933 7 и 4226 7 А. [2]
Кальций рекомендуют связывать в прочные комплексы комп-лексоном III [466, 993, 1629], о-оксихинолином [466], глицерином [1381], легко разрушающиеся в пламени. [3]
Кальций при этом остается в растворе. В присутствии больших количеств NOs-иона нитрат стронция образует ионные пары и кристаллы. Образованию ионных пар способствуют также процессы дегидратации. Азотная кислота дает избыток йитрат-ионов и производит дегидратирующее действие на нитрат стронция, в связи с чем он выделяется из раствора. Фосфорная кислота как дегидратирующий агент тоже понижает растворимость нитрата стронция. Все эти факторы способствуют осаждению нитрата стронция из растворов азотной кислоты, в то время как нитрат кальция в ней хорошо растворим. Удовлетворительные результаты могут быть получены при двойном переосаждении из концентрированной азотной кислоты или двойной обработки спиртово-эфирной смесью. [4]
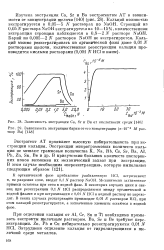 |
Зависимость экстракции Са, Sr и Ва от кислотности среды.| Зависимость экстракции бария от его концентрации ( ге-10 - 3 М раствор В а. [5] |
Кальций полностью экстрагируется в 0 05 - 5 N растворах по NaOH. Стронций из 0 05 N раствора NaOH экстрагируется на 10 - 15 %, количественная экстракция стронция наблюдается в 0 8 - 2 N растворе NaOH. Барий из 0 005 - 2 N растворов NaOH не экстрагируется. [6]
Кальций отделяют от щелочноземельных металлов на ионитах в присутствии комплек-сообразующих агентов. Путем применения элю-ентов различных концентраций или растворов комплексообразую-щих агентов с различным рН достигается последовательное элюирование отдельных компонентов смеси. [7]
Кальций элюируют 0 6 - 1 0 N HG1 [ 1577J, 1 5 N HN03 [943], смесью 1 М растворов муравьиной кислоты и формиата аммония. Для более четкого отделения Fe и А1 элюируют разбавленным раствором соляной кислоты с добавками роданида аммония. [8]
Кальций может быть отделен от фосфора как на катеонитах, так и на анионитах. [9]
Кальций титруют по метилтимоловому синему после добавления к ре-экстракту 25 мл конц. Параллельно титруется раствор холостой пробы. [10]
Кальций легко взаимодействует с кислородом, серой, азотом, водородом и многими другими элементами и при высоких температурах восстанавливает оксиды большинства металлов, поэтому его применяют для раскисления и десульфурации расплавленных металлов. [11]
Кальций обладает следующими физико-химическими свойствами: валентность 2; плотность 1 55 г / см3; температура плавления 1124 К и кипения 1760 К. [12]
Кальций, как правило, окисляется стадийно [441], замедленная стадия - отщепление второго электрона. В растворах ДМА и ДМФ пассивация магния и кальция сопровождается появлением на их поверхности видимых пленок, не растворимых в электролите. [13]
Кальций - широко распространенный химический элемент - входит в состав почти всех природных и промышленных материалов. Поэтому аналитическая химия кальция решает вопросы как определения сравнительно больших количеств кальция в присутствии магния и других сопутствующих элементов ( в этом случае примеси не сказываются, как правило, на точности получаемых результатов), так и определения следов кальция в различных материалах, где точность результатов зависит от приро-ды основы и в большей степени от количественного содержания и природы других примесных элементов. [14]
Кальций может существовать в двух аллотропных модификациях: а - и 3-формах. А, плотность равна 1 54 при 20 С); 3-форма - гексагональную решетку. [15]
Страницы: 1 2 3 4