Карбонат - литий
Cтраница 1
Карбонат лития Li2CO3 термически довольно неустойчив по сравнению с карбонатами других щелочных металлов ( ср. [1]
Карбонат лития - первичное соединение лития, получаемое на заводе в Миннеаполисе; частично перерабатывается на многие другие соединения лития и на металл. [2]
Карбонат лития потребляется в больших масштабах непосредственно и служит источником для получения большой гаммы других соединений. Среди них особое значение имеют гидроокись лития и хлорид лития - пока единственный исходный материал для получения металлического лития. [3]
 |
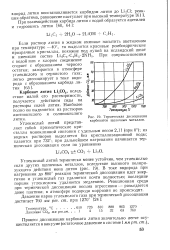
Политерма растворимости Li 2СО3 в воде. [4] |
Карбонат лития по ряду свойств напоминает карбонат кальция. Растворимость Li2CO3 значительно ниже, чем растворимость карбоната любого щелочного металла. [5]
Карбонат лития 1л2СОз применяется в производстве керамических масс, эмалей, глазурей и разных кислотоупорных покрытий. Природные соединения лития используются в производстве молочного стекла. Введение их в стеклянную массу уменьшает хрупкость стекла. Фторид лития LiF придает стеклу способность пропускать ультрафиолетовые лучи и повышает кислотоупорность стекла. Термостойкие литиевые смазки используются в авиации: смазки, содержащие литий, выдерживают температуру от - 50 до 150 С и имеют хорошую механическую и химическую стойкость. [6]
Карбонат лития Li2CO3 - бесцветное мелкокристаллическое вещество, призматические кристаллы которого принадлежат к моноклинной сингонии. Плавится при 732, после плавления застывает в эмалевидную массу. [7]
 |
Термическая диссоциация карбонатов щелочных металлов. [8] |
Карбонат лития Li2C03, вследствие малой его растворимости, получается действием соды на растворы солей лития. Наиболее полно он выделяется из растворов азотнокислого и солянокислого лития. [9]
Карбонат лития Li2CO3 термически довольно неустойчив по сравнению с карбонатами других щелочных металлов ( ср. [10]
Карбонат лития теряет СО2 около 600 С, карбонат натрия - около 800 С и карбонат калия - выше 950 С. [11]
Карбонат лития предложен для разложения глинозема [4.618] и силикатов, в которых определяют натрий [4.619], однако ни Li2CO3, ни его смесь с Na2CO3 [4.620] не получили широкого применения. [12]
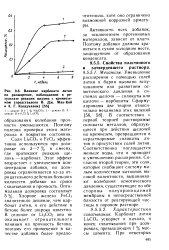 |
Влияние карбоната лития на расширение, наблюдаемое в результате реакции щелочи с кремнеземом ( представлено В. Дж. Мак-Кой и А. Г. Колдуэллом [ 55. [13] |
Карбонат лития 1л2СОз ускоряет и начало, и конец схватывания при дозировках, превышающих I % массы цемента. [14]
Карбонат лития Li2CO3 отличается малой ( по сравнению с углекислыми солями остальных щелочных металлов) растворимостью, что используется в технологии производства литиевых солей. [15]
Страницы: 1 2 3 4