Бимолекулярная константа
Cтраница 1
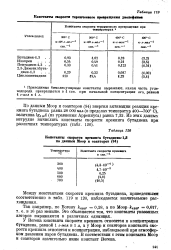 |
Константы скорости термического превращения диоаефивю. [1] |
Приводимые бимолекулярные константы выражают, какая часть углеводорода превращается в 1 сек. [2]
Полученные таким путем бимолекулярные константы [ в л / ( моль мин) ] выражаются уравнениями: lg А 4 0 376 3 17 / ( I) при 25 С и lg кь - 0 693 3 33 / ( /) при 40 С, что соответствует значениям 2А2В, равным 3 11 и 2 94 соответственно. Та же процедура применительно к логарифмам констант кх, кг и к3 дает наклон бренстедов-ских графиков, соответствующий значениям z z - q, равным 17 1, 11 5 и 8 9 соответственно. [3]
Тот же порядок имеют бимолекулярные константы инактивации возбужденных молекул в растворах. [4]
Временно примем за нормальное значение бимолекулярной константы реакции между растворенными веществами А и В такое значение, которое наблюдалось бы, если обе частицы были электронейтральными. Тогда из электростатических соображений следует, что при прочих равных условиях константа скорости увеличится, если заряды частиц противоположны, и уменьшится, ес а заряды одного знака. [5]
Временно примем за нормальное значение бимолекулярной константы реакции между растворенными веществами А и В такое значение, которое наблюдалось бы, если обе частицы были электронейтральными. Тогда из электростатических соображений следует, что при прочих равных условиях константа скорости увеличится, если заряды частиц противоположны, и уменьшится, если заряды одного знака. [6]
Истинный тримолекулярный закон реакции, очевидно, в этом случае можег быть установлен по зависимости бимолекулярной константы. [7]
Приведенные уравнения показывают, что для вычисления константы скорости бимолекулярной реакции ( иногда ее называют бимолекулярной константой) необходимо знать начальные концентрации исходных веществ, а также зависимость изменения концентрации одного из реагирующих веществ от времени реакции. [8]
Но некоторые красители ведут себя иначе, особенно в случаях, когда константы псевдомономолекулярной реакции переводят в бимолекулярные константы делением на концентрацию ионов ОН, На рис. III. [9]
 |
Кинетические кривые для бимолекулярной реакции с участием промежуточного вещества для первого ( а и второго ( б набора констант скоростей. [10] |
Сравнивать непосредственно величины всех трех констант скорости нельзя, так как k - мономолекулярная, a kz и ks - бимолекулярные константы. [11]
 |
Кинетические кривые для бимолекулярной реакции с участием промежуточного вещества для первого ( а и второго ( б набора констант скоростей. [12] |
Сравнивать непосредственно величины всех трех констант скорости нельзя, так как k - мономолекулярная, a k2 и kz - бимолекулярные константы. [13]
Если, в согласии с предыдущим разделом, оба процесса - ( 1) и ( 2) лимитируются диффузией, величины бимолекулярных констант А. [14]
Таким образом, в принципе исследование стационарной кинетики реакции в обоих направлениях позволяет оценить многие индивидуальные константы скорости для продуктивных направлений процесса, а бимолекулярные константы рассчитываются затем как отношение соответствующей константы равновесия к мономолекулярной константе скорости реакции в обратном направлении. Основные условия, при которых возможен относительно полный анализ процесса, заключаются в следующем: а) с помощью современных методов стационарной кинетики должны быть оценены все константы равновесия; б) с помощью некоторых ( или всех) изложенных ниже методов должны быть оценены индивидуальные мономолекулярные константы скорости; в) механизм исследуемой реакции должен быть таким, чтобы ее можно было исследовать в обоих направлениях. Единственной альтернативой изложенной программы исследования является применение метода предстационарной кинетики, который будет рассматриваться в гл. [15]
Страницы: 1 2