Коэффициент - диссоциация
Cтраница 1
Коэффициент диссоциации зависит от концентрации раствора. [1]
 |
Зависимость элек. [2] |
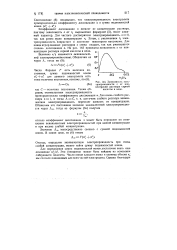
Коэффициент диссоциации а зависит от концентрации раствора, поэтому зависимость о от TJ, выражаемая формулой ( 5), носит сложный характер. Затем, с увеличением щ, электропроводность возрастает и достигает некоторого максимума. Для концентрированных растворов о снова спадает, так как уменьшается степень диссоциации а. На рис. 145 приведена зависимость а от кон-йентрации раствора серной кислоты в воде. [3]
Коэффициент диссоциации изменяется от нуля, когда электролитическая диссоциация отсутствует, до 1 в случае полной диссоциации. Степень электролитической диссоциации зависит от природы растворенного вещества и растворителя, концентрации раствора и температуры. [4]
 |
Молекула хлористого натрия в воде ( схематически. [5] |
Коэффициент диссоциации зависит от концентрации раствора. [6]
Найти коэффициент диссоциации раствора хлористого серебра ( AgCl), если удельное сопротивление его р 0 25 Ом - м при концентрации С 120 кг / м3 и температуре 18 С. [7]
Значение коэффициента диссоциации может быть определено через электропроводность раствора ( см. § 178); а принимает весьма различные значения, меньшие единицы, в зависимости от природы и концентрации раствора. Чистая вода также диссоциирована, но в очень слабой степени. [8]
Величина коэффициента диссоциации а зависит от свойств растворенных солей, температуры и концентрации раствора. [9]
С бинарного комплекса, коэффициент диссоциации которого практически равен нулю. [10]
По мере увеличении концентрации и раствора коэффициент диссоциации а убывает. [11]
 |
Демонстрация отрицательного температурного коэффициента сопротивления у стекла. [12] |
Она тем больше, чем выше коэффициент диссоциации а ( чем больше концентрация ионов / га) и чем больше подвижности ионов Ь и Ь, Выражение (216.2) более удобно представить в другом виде. Величина пе в (216.2) есть полный заряд ионов одного знака, который содержался бы в единице объема электролита, если бы все молекулы были диссоциированы. [13]
Повышение электропроводности жидкостей при нагревании объясняется увеличением коэффициента диссоциации а и, кроме того, увеличением подвижности ионов. [14]
Здесь о - концентрация молекул растворенного вещества; коэффициент диссоциации а п / пв есть отношение концентрации ионов к концентрации молекул вещества. [15]
Страницы: 1 2 3 4