Атом
Cтраница 1
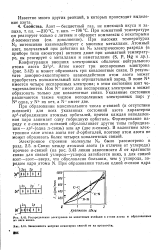 |
Распределение электронов по квантовым ячейкам в атоме азота И образованных из него ионах. [1] |
Атом имеет три неспаренных электрона ( рис. 3.42) и может образовать три ковалентные связи. В результате донорно-акцепторного взаимодействия атом азота может приобретать положительный или отрицательный заряд. В ионе N имеется четыре неспаренных электрона; в этом состоянии азот четырехвалентен. Ион N - имеет два неспаренных электрона и может образовать только две ковалентные связи. Указанные состояния различаются также числом неподеленных электронных пар: у № одна, у N их нет, а N - имеет две. [2]
Атомы и молекулы излучают также и невидимые глазом электромагнитные волны. Электромагнитные волны с К7 5 - 1 ( Н см, заполняющие промежуток между ультракороткими радиоволнами с К 1 - 2 мм и видимым светом, называют инфракрасным излучением. Электромагнитные волны, длины которых заключены в пределах от 3 9 - Ю-5 до 10 - см, называют ультрафиолетовым излучением. [3]
Атомы в большинстве молекул прочно удерживаются вместе благодаря действию так называемых ковалентных связей, имеющих очень важное значение; для этого типа связи характерно то, что пара электронов, осуществляющая связь, одновременно принадлежит обоим связываемым атомам. Такая связь имеет настолько большое значение, так широко представлена в различных веществах, что профессор Калифорнийского университета Джильберт Ньютон Льюис ( 1875 - 1946), открывший ее электронную природу, назвал ее чисто химической связью. [4]
Атомы и ионы не имеют строго определенной внешней границы. Функция распределения электронов обычно достигает максимума для внешней оболочки и затем асимптотически стремится к нулю с увеличением расстояния от ядра. Можно определить кристаллические радиусы для ионов таким образом, что радиусы двух ионов с аналогичными электронными структурами пропорциональны относительной протяженности в пространстве функций распределения электронов для обоих яонов и что сумма двух радиусов равна расстоянию между центрами гоответствующих двух ионов в кристалле. На рис. 6.21 показаны отобранные по этому признаку относительные размеры различных ионов со структурой аргоноидов. [5]
Атом излучает или поглощает энергию квантование при переходе электрона с одной дозволенной орбиты на другую. [6]
Атомы некоторых элементов имеют такое электронное строение, что эти элементы оказываются довольно инертными в химическом отношении. Особенно инертна нулевая группа элементов периодической системы. Ее элементы характеризуются также высокими значениями потенциалов ионизации. Поэтому не удивительно, что элементы этой группы часто называют инертными газами, хотя лучше называть их благородными газами. Очевидно, электронное строение атомов этих элементов обладает особенной устойчивостью к изменениям. Другие атомы ( например, Na, F -, Ca2), изоэлектронные с атомами инертных газов, также довольно инертны в химическом отношении. [7]
Атомы реагируют не только с атомами такого же сорта, но также и с атомами других элементов. Около 95 % всех известных веществ удается вполне разумно описать, если несколько расширить представление об орбитальном перекрывании, которое было изложено выше ( гл. [9]
Атом или группу атомов, замещающую атом водорода в молекуле углеводорода, называют функциональной группой. [10]
Атом в голове мостика в этих соединениях может быть не только азотом, но и любым другим атомом с валентностью, равной трем или более. [11]
Атом или группа X непосредственно участвуют в образовании комплекса, вследствие чего одна или две карбоксильные группы остаются свободными. Последовательность отдельных групп в отношении их действия зависит от характера связанного иона металла. [12]
Атомы и ионы нужно представлять не как твердые шары, а как образования с электронной оболочкой, способной деформироваться. [13]
Атомы мигрируют через междоузлия решетки. Это движение требует сильной деформации решетки, которая связана с высокой энергией активации. [14]
Атомы, ионы или молекулы, попадающие на кристалл из паровой фазы или оседают на поверхности, или отражаются от нее. Для частиц, остающихся на поверхности, имеются различные возможности: 1) пробыв определенное время на поверхности, они покидают ее и вновь поступают в паровое пространство; 2) частицы удерживаются непосредственно на месте встречи с поверхностью; 3) путем диффузии частицы перемещаются на поверхности кристалла. Обоснования такого подхода были даны Фольмером. [15]
Страницы: 1 2 3 4
