Металл - группа
Cтраница 1
Металлы группы могут быть электролитически выделены в чистом виде из водных растворов. Металлы неводной группы из водных растворов в принципе электролитически выделены быть не могут. К неводной группе относятся также промежуточные в рамках приведенной классификации металлы - вольфрам, молибден, германий, выделение которых из водных растворов в чистом виде термодинамически разрешено, однако на практике электролиз приводит лишь к осаждению сплавов. [1]
Металлы группы 1Б характеризуются значительно меньшими потенциалами разомкнутой цепи. Такая закономерность соответствует порядку изменения й-электронного характера металлов в ряду. [2]
Металлы групп d и / называют переходными, s и р - простыми. Среди - металлов выделяют щелочные и щелочно-земельные, из - платиновые металлы. Группа редкоземельных элементов включает как d -, так и / - металлы. [3]
Металлы I группы реагируют со многими неметаллами, образуя одно или несколько бинарных соединений; кроме того, они образуют ряд сплавов и соединений с другими металлами, такими, как РЬ и Sn. Многие из этих соединений приведены вместе с описанием соответствующего элемента, хотя некоторые классы соединений будут рассмотрены в этой главе. [4]
Металлы VIII группы все серого цвета и тугоплавки. [5]
Металлы VI-VIII групп по отношению к водороду малоактивны. Так, энтальпия образования FeH2 всего - 0 84 кДж / моль. Исключение составляет палладий, который поглощает водород очень активно. [6]
Металлы III группы имеют резко выраженные амфо-терные свойства. Ярким примером этому служит алюминий. [7]
Металлы VI-VIII групп по отношению к водороду малоактивны. [8]
Металлы VIII группы применяют главным образом в процессах гидрирования ненасыщенных углеводородов и отчасти при дегидрировании ряда органических соединений. [9]
Металлы VIII группы все серого цвета и тугоплавки. Плавкость возрастает при переходе от Fe к Со и Ni, как в ряде Ru, Rh, Pd или при переходе от Os к Ir и Pt. Металлы эти обладают малыми, сравнительно даже с соседними числами, объемами атомов, напр. [10]
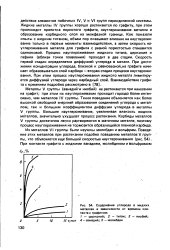 |
Содержание углерода в жидких металлах в зависимости от времени контакта с графитом. [11] |
Металлы V группы ( ванадий и ниобий) не растекаются при нанесении на графит; при этом их науглероживание проходит гораздо более интенсивно, чем металлов IV группы. Такое поведение объясняется как более высокой свободной энергией образования соединений углерода с металлом, так и большим коэффициентом диффузии углерода, в металлы V группы. Большее науглероживание, увеличивая вязкость жидких металлов, значительно ухудшает процесс растекания. Карбиды металлов V группы достаточно легко растворяются в маточном металле-поэтому процесс науглероживания не тормозится образующейся пленкой карбида. [12]
Металлы VIII группы образуют три побочные подгруппы железа, кобальта и никеля. Но по исторически сложившейся систематике и по сходству свойств принято объединять Fe, Co, и Ni в семейство железа, а остальные шесть элементов ( Ru, Rh, Pd, Os, Ir и Pt) называть платиновыми металлами. [13]
 |
Электронные конфигурации атомов элементов К группы. [14] |
Металлы II группы по химическим свойствам делятся на две подгруппы: 1) главная - подгруппа бериллия; в нее входят: бериллий, магний, кальций, стронций, барий и радий; 2) побочная-подгруппа цинка; в нее входят: цинк, кадмий и ртуть. В этом отношении наблюдается аналогия с металлами I группы. [15]
Страницы: 1 2 3 4