Молекула - вода
Cтраница 1
Молекулы воды очень устойчивы при нагревании. Водяной пар начинает заметно диссоциировать только при t 1000 С по уравнению: 2Н20 2Н2 02 - 137 ккал. [1]
 |
Некоторые ионы, изоэлектронные с атомами благородных газов. [2] |
Молекулы воды, связанные водородными связями, образуют протяженный трехмерный каркас, в пустотах которого располагаются атомы инертных газов. Возможно, анестезирующее действие ксенона ( и многих других анестезирующих веществ) обусловлено образованием водных хлатратов в физиологически активных центрах. Прекращение действия анестезирующего вещества, по-видимому, обусловлено нарушением равновесия этого процесса, клатрат разрушается, и к человеку, находящемуся под наркозом, возвращается сознание. [3]
Молекулы воды, участвуя в тепловом движении, имеют различные скорости. Те из них, скорость которых и по направлению и по значению оказывается достаточной, преодолевают силы взаимного притяжения других молекул и вылетают в газовое пространство. Передвигаясь по всем направлениям в этом газовом пространстве, молекулы Н2О могут вновь оказаться в водной среде. Вследствие громадного числа молекул более или менее быстро наступает статистическое равновесие, когда число молекул воды, пересекающих поверхность раздела газ - вода, становится одинаковым в обоих направлениях. Наступившее равновесие нарушается при изменении, например, температуры жидкости. При этом скорость молекул возрастает и увеличивается их количество, перешедшее поверхность раздела газ - вода. Такое повышение увеличивает количество молекул, переходящих из газа в жидкость и опять наступает состояние равновесия, но уже при иных температуре и давлении. [4]
Молекулы воды в кристалле рубредоксина связаны водородными связями с группами белка и друг с другом. Кристаллографическая структура растворителя в рубредоксине качественно сходна с рассчитанной структурой воды в кристалле ИТПЖБ; однако интервал значений кристаллографических температурных факторов воды в рубредоксине ( от 15 до 60) соответствует менее упорядоченной структуре, чем рассчитанная структура растворителя в ИТПЖБ. [5]
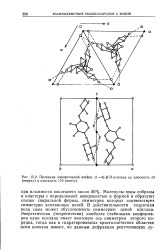 |
Проекции элементарной ячейки ( 1 - - 4 - [ - О-ксилана на плоскость аЬ ( вверху и плоскость 110 ( внизу. [6] |
Молекулы воды собраны в кластеры с определенной поверхностью и формой и образуют стопки спиральной формы, симметрия которых соответствует симметрии неплановых цепей. В действительности гидратная вода сама может обусловливать симметрию цепей ксилана. [7]
Молекулы воды стабилизуют структуру с винтовой осью третьего порядка путем образования водородных связей. Такая структура может служить примером гидратации, протекающей с образованием стопок, что обеспечивает возможность расширения ( разбухания) элементарной ячейки с увеличением влажности и соответственно степени гидратации полисахарида. При 58 % - ной относительной влажности элементарная ячейка содержит одну, а при 90 % - ной - две молекулы воды на остаток ксилозы. При очень низкой относительной влажности кристалличность ксилана низкая. В табл. 15.1 указаны параметры элементарной ячейки различных полиморфных модификаций полисахарида. [8]
Молекула воды Н20 имеет уголковую форму, вершиной угла ( он равен 105) является атом кислорода. [9]
Молекула воды построена несимметрично, это дипольная ( полярная) молекула. Ее дипольный момент равен 1 84 - 10 - 18 эл. [10]
Молекула воды построена несимметрично, это дипольная ( полярная ] молекула. [11]
Молекулы воды заполняют образовавшиеся промежутки между ионами; при этом выделяется энергия гидратации металлических ионов. [12]
Молекулы воды хотя и в очень слабой степени, но ионизированы. Иными словами, при взаимодействии молекул воды осуществляется перенос протона с одной молекулы на другую. [13]
Молекулы воды не вступают во взаимодействие с гидроксильной группой данной молекулы. [14]
Молекулы воды очень устойчивы и лишь при температуре выше 1000 С начинают распадаться на водород и кислород. Под действием электрического тока вода довольно легко разлагается на простые вещества. Для этого воду, подкисленную серной кислотой для лучшей электропроводности, наливают в специальный прибор ( рис. 34) и соединяют электроды с полюсами источника тока. Включив ток, наблюдают, как над электродами накапливаются газы, причем над катодом газа собирается в два раза больше, чем над анодом. Ассоциация дипо - 2 объема водорода получается 1 объем кисло-лей воды. [15]
Страницы: 1 2 3 4 5