Направленность - связь
Cтраница 1
 |
Схема перекрывания орбиталей при образовании а . [1] |
Направленность связи выражается в том, что она имеет вполне определенную форму. Связь, образованную электронным облаком, имеющим максимальную плотность на линии, соединяющей центры атомов, называют сигма-связью. Связь, образованную электронами, орби-тали которых дают наибольшее перекрывание по обе стороны от линии, соединяющей центры атомов, называют пи-связью. Дельта-связь образуется при перекрывании всех четырех лопастей cf - элек-тронных облаков, расположенных в параллельных плоскостях. Как видно из рис. 13.5, электроны s - орбиталей могут участвовать лишь в образовании 0-связей, р-электроны - в образовании а -, я-связей, d - электроны - в образовании а -, л - и б-связей. Поскольку электронные облака ( кроме s - облака) направлены в пространстве, химические связи, образованные с их участием, также пространственно направлены. [2]
 |
Схема перекрывания электронных облаков при образовании молекул НаО и NHS. [3] |
Направленность связей в молекуле воды определяет ее угловую конфигурацию. Подобную им форму имеют сходные молекулы, образованные элементами - аналогами кислорода: серой, селеном и теллуром. [4]
 |
Гибридизация орбиталей. [5] |
Направленность связей в молекулах NHs и - НгО также может быть объяснена с точки зрения гибридизации электронных орбита-лей. В гибридизации могут участвовать орбитали, заполненные наполовину и полностью. Таким образом в атоме азота наряду с тремя 2р - орбиталями в гибридизации может принимать участие и 2 s - орбиталь. В результате гибридизации можно ожидать, что четыре гибридные орбитали будут направлены к вершинам тетраэдра. [6]
Направленность связей в молекуле воды определяет ее угловую конфигурацию. Подобную форму имеют сходные молекулы, образованные элементами - аналогами кислорода: серой, селеном и теллуром. [7]
Направленность связей характерна для ковалентных кристаллов, например для углерода, кремния. [8]
Направленность связи у атомов металла придает химической связи этих соединений преимущественно ковалентный характер. Формальный ковалентный заряд атомов соединения AnIBVI может быть изображен как А 1 и В 1, например Ga S, поскольку при р3 - гибридизации 52р - электроны галлия образуют общую гибридизированную орбиту с р-электронами серы, отдающей в связь один электрон. Отрицательный заряд металла и положительный заряд неметалла снижаются вследствие ионности связи в этих соединениях. Связь между слоями в этих соединениях будет типа связи Ван-дер - Ваальса, что выражается в чрезвычайно высокой способности к расщеплению слоев этих соединений на пластинки любой толщины с идеально гладкой поверхностью. [9]
 |
Схемы образования молекул аммиака ( а и. [10] |
Направленность связей в молекулах МНз и ШО также может быть объяснена с точки зрения гибридизации электронных орбнталей. В гибридизации могут участвовать орбитали, заполненные наполовину и полностью. [11]
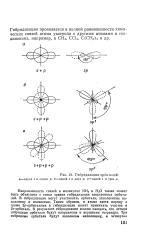 |
Гибридизация орбиталей. а-одной s и одной р. 6-одной s и двух р. в-одной s и трех р. [12] |
Направленность связей в молекулах NH3 и Н20 также может быть объяснена с точки зрения гибридизации электронных орбита-лей. В гибридизации могут участвовать орбитали, заполненные наполовину и полностью. Таким образом, в атоме азота наряду с тремя 2р - орбиталями в гибридизации может принимать участие и 2 -орбиталь. В результате гибридизации можно ожидать, что четыре гибридные орбитали будут направлены к вершинам тетраэдра. [13]
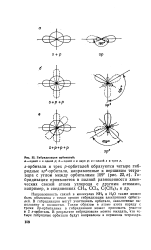 |
Гибридизация орбиталей. [14] |
Направленность связей в молекулах NHs и Н2О также может быть объяснена с точки зрения гибридизации электронных орбита-лей. В гибридизации могут участвовать орбитали, заполненные наполовину и полностью. Таким образом в атоме азота наряду с тремя 2р - орбиталями в гибридизации может принимать участие и 2 s - орбиталь. В результате гибридизации можно ожидать, что четыре гибридные орбитали будут направлены к вершинам тетраэдра. [15]
Страницы: 1 2 3 4