Образование - двуокись - титан
Cтраница 1
Образование двуокиси титана TiO2, получающейся в виде белого порошка, удельный вес которого зависит от температуры прокаливания, имеет место при сжигании титана в избытке кислорода, при разложении титаном водяных паров в интервале температур 700 - 800 и при прокаливании гидроокиси четырехвалентного титана. Двуокись титана, прокаленная при температуре - 700, обладает структурой анатаза, которая при температуре 850 - 900 переходит в структуру рутила. [1]
Теплота образования двуокиси титана составляет 218 ккал / моль. [2]
Способ заключается в образовании двуокиси титана непосредственно во время процесса полимеризации. Капролактам смешивают с Ti ( OH) 4 - H2O, получаемым при гидролизе сульфата титана, и затем проводят процесс полимеризации. Данные о практическом применении этого способа отсутствуют. [3]
Если имеется достаточное количество воды, то все диэтил-гексальные группы с образованием двуокиси титана могут быть удалены; в результате будет высвобождено дополнительное количество диэтилгексанола. [4]
Непосредственное восстановление двуокиси титана до металлического титана не дало удовлетворительных результатов, что объясняется большой теплотой образования двуокиси титана ( около 200 ккал / моль) и значительной растворимостью в титане кислорода. Поэтому в настоящее время большую часть промышленного титана получают переводом двуокиси титана в четыреххлористый титан с последующим его восстановлением. Двуокись титана хлорируют np i 800 С в присутствии угля или молотого графита на непрерывно действующих специальных установках. [5]
Непосредственное восстановление двуокиси титана до металлического титана не дало удовлетворительных результатов, что объясняется большой теплотой образования двуокиси титана ( около 200 ккал / моль) и значительной растворимостью в титане кислорода. Поэтому в настоящее время большую часть промышленного титана получают переводом двуокиси титана в четыреххлористый титан с последующим его восстановлением. Двуокись титана хлорируют при 800 С в присутствии угля или молотого графита на непрерывно действующих специальных установках. [6]
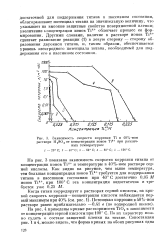 |
Зависимость скорости коррозии Ti в 40 % - ном растворе H2SO4 от концентрации ионов Ti4 при различных температурах. [7] |
Другими словами, наличие в растворе ионов Ti4 сдвигает равновесие реакции ( 1) в левую сторону - сторону образования двуокиси титана, и, таким образом, обеспечивается уровень электродного потенциала титана, необходимый для поддержания его в пассивном состоянии. [8]
Процесс получения пигментной ТЮ2 сжиганием TiCU связан с большими трудностями, так как вследствие большой скорости реакции имеется опасность образования двуокиси титана с дефектной кристаллической решеткой и высокой поверхностной активностью. Под действием же высокой температуры велика склонность частиц к росту, агрегации и спеканию, в связи с этим необходимо строго регулировать условия синтеза и время пребывания продукта реакции в зоне высоких температур, так как лишь при этом можно получить двуокись титана с необходимыми пигментными свойствами. По ряду данных [50] лучшее регулирование процесса может быть достигнуто разбавлением TiCl4 инертным газом ( азотом), однако при этом отходящий хлор разбавляется и нуждается в регенерации. [9]
Купферроновое производное не представляет собой весовой формы, а поэтому для получения последней прокаливают осадок, принимая необходимые предосторожности, до образования двуокиси титана, которую и взвешивают. [10]
При сгорании грамм-молекулы карбида титана выделяется 202 45 ккал тепла. Тепловой эффект образования двуокиси титана и двуокиси углерода соответственно равен 218 и 94 45 ккал. [11]
При сгорании грамм-молекулы карбида титана выделяется 202 45 ккал тепла. Тепловой эффект образования двуокиси титана и двуокиси углерода соответственно равен 218 и 94 45 ккал. [12]
При сгорании грамм-молекулы карбида титана выделяется 220 45 ккал тепла. Тепловой эффект образования двуокиси титана и двуокиси углерода соответственно равен 218 и 94 45 ккал. [13]
В технологическом процессе получения двуокиси титана из сульфата титанила и аммония ( СТА) основной операцией является термический гидролиз, при котором титан переходит в виде гидроокиси в осадок. Дальнейшая обработка осадка, его прокаливание приводят к образованию двуокиси титана, свойства которой в значительной степени обусловлены характером гидролиза. Процесс гидролиза в растворах СТА связан с состоянием титана в растворе и изменениями, происходящими как в жидкой, так и в твердой фазах. [14]
Двуокись титана получается путем прокаливания продукта гидролиза солей титана. При этом происходит обезвоживание и разложение основной соли и образование двуокиси титана с некоторым увеличением размера частиц. Вода удаляется в интервале температур 200 - 300 С, а разложение основной массы солей - при 500 - 700, С. Остающиеся группы SC4 - придают продуктам прокаливания кислый характер. [15]
Страницы: 1 2