Гальваническая пара
Cтраница 2
Потенциал гальванической пары железо ( П) железо ( Ш) равен - 0 771 В, толда как пара iHg2 ртуть ( П) создает потенциал 0 910 В. [16]
Рассмотрим гальваническую пару из цинкового и водородного электродов. [17]
Составляя гальваническую пару по приведенной схеме с произвольной концентрацией ионов водорода в сосуде, куда опущен водородный электрод, и определяя компенсационным методом Е, получаем возможность вычислить рН раствора. [18]
В гальванической паре никель - железо никель является катодом по отношению к железу и поэтому защищает основу ( различные углеродистые сплавы) только при условии полной беспористости покрытия. Так как гальванически осажденный никель даже в слое толщиной 25 - 30 мк обладает пористостью, то для более надежной защиты стали от коррозии он применяется обычно с подслоем меди. [19]
В гальванической паре олово - железо слой олова является катодом по отношению к железу, и поэтому оловянное покрытие защищает сталь от коррозии только в тех случаях, когда оно сплошное и беспористое. При наличии пор олово может даже ускорить коррозию основного металла. [20]
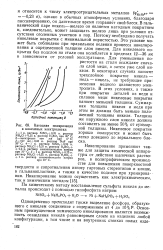 |
Катодная поляризация в никелевых электролитах. [21] |
В гальванической паре никель-железо он является катодным покрытием и, следовательно, может защищать железо лишь при условии от сутствия оголенных участков и пор. Поэтому необходимо получать никелевые покрытия с минимальной пористостью. Это условие может быть соблюдено при правильном ведении процесса никелирования и определенной толщине слоя никеля. Для никелевого покрытия без подслоя на стали она колеблется в пределах 12 - 36 мк в зависимости от условий эксплуатации. Для уменьшения пористости на стали осаждают сначала слой меди, а затем уже слой никеля. [22]
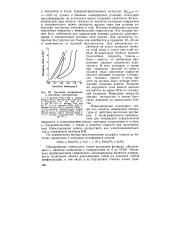 |
Катодная поляризация в никелевых электролитах. [23] |
В гальванической паре никель - железо он является катодным покрытием и, следовательно, может защищать железо лишь при условии от сутствия оголенных участков и пор. Поэтому необходимо получать никелевые покрытия с минимальной пористостью. Это условие может быть соблюдено при правильном ведении процесса никелирования и определенной толщине слоя никеля. Для никелевого покрытия без подслоя на стали она колеблется в пределах 12 - 36 мк в зависимости от условий эксплуатации. [24]
В гальванической паре Fe - Sn анодом будет уже железо, которое и разрушается ( рис. 107, б), а катодом - олово. Следовательно, олово защищает железо от коррозии до тех пор, пока оно обеспечивает сплошное его покрытие. Подобные же явления происходят и тогда, когда в металле, находящемся в электролите, будут находиться примеси других металлов. В этом случае на поверхности металла и в его трещинах возникает множество микрогальванических элементов, в которых примеси обычно представляют собой катоды, а кристаллики самого металла аноды. В стали находятся кристаллики железа, карбида железа Fe3C и углерода. В электролите разрушается железо. [25]
В образовавшейся гальванической паре протектор Б является анодом, а защищаемая конструкция А - катодом. [26]
В искусственно образованной гальванической паре один полуэлемент ( трубопровод) оказывается катодом, коррозия которого резко замедляется или прекращается совсем, а другой полуэлемент ( протектор) оказывается анодом, который корродирует более сильно, так как подвергается действию электрического тока, стекающего с него в процессе работы данного гальванического элемента. [27]
В чугуне гальваническая пара феррит - графит обладает большой электродвижущей силой ( о 564 в), поэтому скорость растворения чугуна в электролитах очень значительна. Разрушение чугуна происходит главным образом около графитовых включений, и чем их больше, тем меньше коррозионное сопротивление чугуна. Однако чрезмерно крупный графит также нежелателен, ибо он уменьшает плотность отливки. [28]
Например, гальваническая пара Fe-Zn в горячей водопроводной воде меняет свою полярность так: потенциал цинка облагораживается и цинк становится катодом по отношению к железу, потенциал которого с повышением температуры становится отрицательнее. [29]
 |
Электролитический ключ.| Схема переключателя тока ( вид сверху. [30] |
Страницы: 1 2 3 4