Пентафторид
Cтраница 1
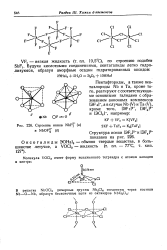 |
Строение ионов NbF - ( a. [1] |
Пентафториды, а также пен-тахлориды Nb и Та, кроме того, реагируют с соответствующими основными галидами с образованием анионных комплексов OF el, а в случае Nb ( V) и Та ( V), кроме того, [ ЭР. [2]
Пентафторид МоР5, тетрафторид МоР4 и трифто-рид МоР3 диспропорционируют при нагр. Пента-фторнд Мо и низшие фториды получают восстановлением МоР6 металлами или 81, взаимод. [3]
Пентафторид 8ЪР5 - вязкая жидкость; образует полимеры, устойчивые в парах до 200 - 250 С; ур-ние температурной зависимости давления пара: 1 § ХПа) 10 691 - - 2634 / Т ( 320 1 Г 416 4); хорошо раств. НР ( с понижением степени полимеризации и образованием ионов 8ЬР и 8Ъ2РГ), в Н8О3Р; образует дигидрат; сильная к-та Льюиса, р-ры 5ЪР5 в НР и НЗО3Р - сверхкислоты; с 12 образует 8ЫР5 и 8Ь21Рю, с серой - 8Ь8Р3, с 8ЬР - фториды общей ф-лы 8ЬР5 - ( 8ЬР3), где п - - 2 - 5, а также 38ЬР3 - 58ЬР; получают фторированием 8Ь или 8Ь2О3, взаимод. [4]
Пентафторид представляет собой промежуточный или побочный продукт и других реакций, например реакции окисления UF4 сухим кислородом или взаимодействия UF4 с трехфтори-стым хлором или с фтором. Впервые он был приготовлен Руф-фом и Хайнцельманом112 из пятихлористого урана и фтористого, водорода. [5]
 |
Характеристика фторидов иода. [6] |
Пентафторид и гептафторид иода наиболее изучены, и для них имеются многочисленные данные о химических свойствах, структуре и физических свойствах. Кроме того, значение этих соединений определяется еще и тем, что они находят промышленное применение. [7]
Пентафторид хрома, CrF5, выделяют как побочный продукт в небольших количествах при получении тетрафторида хрома. [8]
Пентафторид нептуния не был получен. На основании теплоты образования-467 ккал / молъ предполагают, что NpF5 должен был бы быть устойчивым соединением. [9]
Пентафторид платины [45] наиболее удобно получать реакцией фтора, разбавленного азотом, с дихлоридом платины при 350 в кварцевой трубке. Пентафторид осаждается на холодных стенках кварцевой трубки вне зоны реакции в виде темно-красного твердого вещества. Пентафторид платины плавят и выливают в боковой отросток. Реакция диспропорционирования не позволяет проводить сублимацию в вакууме. [10]
Пентафторид ванадия рассматривается в другом месте. Последнее соединение является производным гипотетического оксифторида V02F; оно образуется в результате неполной нейтрализации аммиаком раствора пятиокиси ванадия во фтористоводородной кислоте. О структурах фторованадатов известно мало, в связи с чем трудно судить о сходстве и различии между этими соединениями и соответствующими хлорованадатами. [11]
Пентафторид ванадия был получен фторированием порошкообразного металла в никелевой лодочке при 300 С, он плавится при 19 5 С и кипит при 48 3 С. [12]
Безводный пентафторид получается действием фтора при 700 С на безводный тетрафторид протактиния или трех - и пятифтори-стого брома на пятиокись протактиния при 600 С. [13]
Пентафторид ванадия VFs - единственное соединение, в котором на 1 атом ванадия приходится 5 атомов галогена. [14]
Такие пентафториды, как, например, PF5, построены на тех же принципах, что и SF6, с той разницей, что основными связями в случае PF5 являются гибридные связиsp3d, направленные в углы тригональной бипирамиды. В связи с этим следует ожидать, что такие соединения должны иметь несколько более ионный характер. [15]
Страницы: 1 2 3 4