Перекись - серебро
Cтраница 1
Перекись серебра образуется действием надсернокислого калия на азотнокислое серебро в водных растворах. [1]
Перекись серебра образуется на аноде при электролизе концентрированного водного раствора нитрата серебра. [2]
Перекись серебра - порошок серо-черного цвета; на воздухе относительно устойчива. [3]
Перекись серебра Ag2O2 - другое кислородное соединение серебра - порошкообразное малоустойчивое вещество темно-серого цвета, способное при повышенной температуре ( 110 С) взрываться. [4]
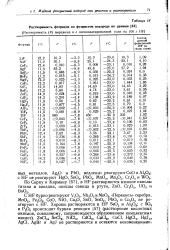 |
Растворимость фторидов во фтористом водороде по данным. [5] |
Перекись серебра, MnO2, Fe2O3, CoO, NiO, Cu2O, SnO, SnO2, PbO2 и Со2О3 не реагируют с HF. [6]
Перекись серебра образуется действии озона на металлическое серебро. Взаимодействие исходит только с влажным озоном и с заметной скоростью лишь - ] при на грека и ни. Метал-J лическис катализаторы, кик окись железа, следы других окислов затем рутений, палладий и платина, действуют в качестве носчиков кислорода и уже при более низких температура. Раствор озона в жидком кислороде в серебряном тигле также вызывает в течение несколь - - ] ких минут образование перекиси. При пропускании озона чср з растворы азоч но - или сернокислого серебра выпадает синевато - черный осадок перекиси. Кроме озона, н другие энергичные окислители, например персульфаты калия или аммония, способны осаждать перекись из растворов азотнокислого серебра. [7]
Перекись серебра представляет собой вполне определенное ] соединение. При более высоких температурах про - Ц исходит разложение на серебро и кислород. В азотной кислоте л перекись серебра растворяется с образованием темнокоричпевой. Горячая разбавленная с-грпаи кислота разлагает ее с выделением кислорода и с образо-шишгм сернокис. Органические соединения сильно окисляются сю. [8]
Хотя известна перекись серебра, которую считали содержащей AgO и которую Вертело ( 1880) признал за полуторную окись Ag 2O3, но она настоящих солей не образует и, следовательно, не может быть поставлена в ряд с окисью меди. В отличие от меди, серебро есть металл, не окисляющийся в жару; его окислы Ag2O и Ag2O3 легко выделяют кислород ( доп. Серебро не окисляется и на воздухе, а потому причисляется к разряду гак называемых благородных металлов. Оно обладает белым цветом, гораздо более чистым, чем для всех других известных металлов, в особенности когда оно представляет химическую чистоту. [9]
Согласно Кемпфу 3 перекись серебра, которая является промежуточным продуктом в этой реакции, постоянно регенерируется. [10]
Он окислил хинон перекисью серебра ( полученной смешением растворов персульфата калия с азотнокислым серебром); продуктами были малеиновая и муравьиная кислоты, окись углерода и углекислота. [11]
По современным воззрениям так называемая перекись серебра в действительности представляет не истинную перекись, а только окись двухвалентного серебра AgO. Однако не исключена возможность существования и перекиси одновалентного серебра. Имеющиеся данные не позволяют дать на этот вопрос однозначный ответ. [12]
Прежние утверждения о невозможности существования перекиси серебра и о протекании лишь атомарной монослойной адсорбции газообразного кислорода на серебре опровергаются, ибо перекисная теория Траубе - Менделеева - Баха - Энглера оказалась применимой и к серебру. [13]
Окись серебра Ag2O, так же как и более высокие окислы, как перекись серебра Ag2O2, приготовляются путем электролитического окисления. [14]
Более богатое кислородом соединение серебра AgO, которое иногда называют двуокисью, иногда перекисью серебра, еще менее устойчиво. Таким образом, получить его нагреванием нельзя, а приходится итти косвенными путями, окисляя Ag2O в щелочном растворе. [15]
Страницы: 1 2 3 4