Потеря - кристаллизационная вода
Cтраница 1
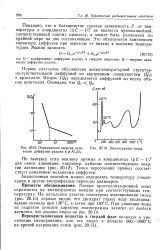 |
Определение энергии активации диффузии радона в а - А. 2Оз. [1] |
Потеря кристаллизационной воды отражается на эманограммах пиками при соответствующих температурах. На начальном участке политермы эманирования гипса ( рис. 20.13) хорошо видно, что дигидрат теряет воду последовательно сначала при 130 С, а затем при 180 С. [2]
 |
Разделение смесей этана и этилена на твердых сорбентах. [3] |
При потере кристаллизационной воды цеолиты сохраняют свою структуру, благодаря чему в кристаллах образуются малого размера ( молекулярные) поры. В эти поры могут входить и сорбироваться только молекулы небольших размеров. [4]
Данные о потере кристаллизационной воды довольно противоречивы. С, по [19] ВаС12 - 2Н2О теряет одну молекулу кристаллизационной воды при 120 С, а при 171 С полностью обезвоживается, по [20], первая молекула воды теряется при 105, вторая - при 160 С. [5]
 |
Изменение растворимости. [6] |
При 60 происходит потеря кристаллизационной воды и, следовательно, изменение кристаллической решетки. Это свойство сернокислого кальция проявляется при образовании накипи. Сернокислый кальций менее растворим при нагревании и поэтому выделяется из насыщенного раствора в наиболее горячих частях системы, в частности на стенках труб паровых котлов. По этой же причине кипячение взвеси таких осадков в колбе или стакане приводит иногда к толчкам и разбрызгиванию раствора. [7]
Учитывая, что потеря кристаллизационной воды сульфатом алюминия при 100 С составляет 14 %, количество кристаллогидрата для гашения 1 кг извести находим из расчета G3 0 028X 1 0: 0 14 0 2 кг A / 2 ( SO4) 3 18Н2О / кг композиции. [8]
С приводит к потере кристаллизационной воды. [9]
Литературные данные о потере кристаллизационной воды дигидратом противоречивы. Так, Берг [1] считает, что дигид-рат теряет всю влагу при 110 С. Дымчишин [2] указывает, что температура начала потери кристаллизационной воды, 109 С, а Позин [3] отмечает, что кристаллизационная вода теряется выше 113 С. По данным [4], при проведении экспериментов с навеской, равной 3 г, дигидрат целиком переходит в моногидрат при 100 С за 3 - 4 ч, дальнейшее нагревание пробы приводит к полному удалению влаги с получением сухого продукта. [10]
При температуре выше 30 G начинается потеря кристаллизационной воды, при 100 С происходит полное обезвоживание. Безводная щавелевая кислота сильно гигроскопична и снова поглощает влагу из воздуха. [11]
 |
Дифференциальные кривые термограмм. о - капрон. б - капрон 8 % железа. в - капрон - Ь 30 % железа. г - формиат железа. д - металлополимер на основе капрона с 30 % - ным содержанием железа. [12] |
Появление эндотермических эффектов при 142 и 205 связано с потерей кристаллизационной воды и разложением формиата кобальта, а эффект при 216 - с плавлением капрона. Следующий за ним экзотермический эффект с максимумом при температуре 232, по-видимому, связан с хемосорбционным взаимодействием расплава капрона и поверхности высокодисперсных частиц кобальта, образующихся при разложении формиата. [13]
При нагревании в интервале 30 - 97 С также происходит потеря кристаллизационной воды. Последняя может вступать в реакцию с безводной солью и разлагать ее. С; цри этой температуре начинает отщепляться иод. Дигид-рат частично разлагается водой с образованием РЬЬ. В водном растворе устойчив только в присутствии большого избытка KI. Легко растворяется в ацетоне с образованием светло-желтого раствора. [14]
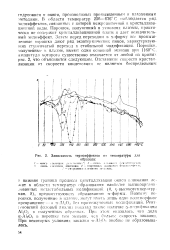 |
Зависимость термоэффектов от температуры для образцов. [15] |
Страницы: 1 2 3 4