Процесс - окисление - никель
Cтраница 1
Процесс окисления никеля ускоряется при одновременном присутствии едкой щелочи и окислителя с образованием аминонитратных комплексов различного состава, которые претерпевают значительные изменения. [1]
Сравнение электронограммы пленок, длительно окислявшихся в сухой и во влажной атмосфере, свидетельствует о незначительной роли воды в процессе окисления никеля. Очевидно, не происходит также образования гидроокиси никеля. Окисление пленок при 100 - 200 не вызывает резких изменений в ширине линий. Значительное сужение линий на электроно-граммах при окислении образцов в температурном интервале 280 - 400, вероятно, связано и с рекристаллизационными явлениями, хотя им сопутствует и процесс утолщения пленки. [2]
Закись никеля способна растворяться в расплавленном никеле. Процесс окисления расплавленного никеля разделяется на две стадии; сначала кислород растворяется в расплавленном металле, а после достижения предела растворимости начинается реакция образования закиси никеля. Растворимость кислорода в никеле увеличивается с увеличением температуры и составляет 0 067 % при 1470 и 1 18 % при 1720 С. При этом закись никеля NiO не образует непрерывного слоя, но проникает в расплавленный металл в форме дендритов. [3]
К этому необходимо, конечно, добавить, что указанное выше значение потенциала обратимого Ni - № ( ОН) 2-элек-трода отнесено к нормальному кристаллическому никелю как исходному материалу и твердому Ni ( OH) 2 как конечному продукту. Однако, имея дело с никелем Ренея, нельзя говорить о действительном кристалле никеля, а гидроокись никеля нужно, по-видимому, рассматривать скорее как несте-хиометрическое образование на поверхности электрода. Поэтому процесс окисления никеля Ренея также должен соответствовать не определенному потенциалу, а известной области потенциалов, в которой каждое значение соответствует определенной степени окисления поверхности. [4]
К этому необходимо, конечно, добавить, что указанное выше значение потенциала обратимого Ni / Ni ( OH) 2-электрода отнесено к нормальному кристаллическому никелю как исходному материалу и твердому Ni ( OH) 2 как конечному продукту. Однако, имея дело с никелем Ренея, нельзя говорить о действительном кристалле никеля, а гидроокись никеля нужно, по-видимому, рассматривать скорее как нестехиометрическое образование на поверхности электрода. Поэтому процесс окисления никеля Ренея также должен соответствовать не определенному потенциалу, а известной области потенциалов, в которой каждое значение соответствует определенной степени окисления поверхности. [5]
Как и на других активных ( неблагородных) металлах, на никеле при взаимодействии с кислородом воздуха в условиях комнатной температуры возникает окисная пленка. Пленка бесцветна и прозрачна. Поэтому наблюдение ее простым глазом или под микроскопом невозможно, если она находится на поверхности металла. Предельная толщина окис-ной пленки на никеле непосредственно нами не измерялась, на опыты определения механического эффекта процесса окисления никеля [5] указывают на существование предела его окисления в условиях комнатной температуры. [6]
Кроме того, сравнение результатов электронографического исследования процессов роста окисных пленок на никелевых катоде и аноде подтверждает второстепенное значение электрического поля, устанавливающегося в слое окисла на металле при окислении в электрическом разряде. Как показал опыт, катодное окисление приводит к значительно большему эффекту утолщения пленки, чем анодный процесс, что убеждает в неприменимости в этом случае обычных представлений об ионном механизме окисления. Повидимому, при пониженных температурах ( так же как это показано В. И. Архаровым [10] для высоких температур) процесс окисления никеля совершается преимущественно вследствие диффузии атомов кислорода через решетку окиси никеля. [7]
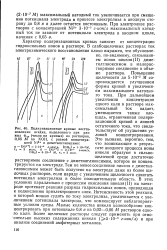 |
Поляризационные кривые восстановления осадка, выделенного при разных фэл ( числа на кривых из растворов, 0 05 М по КОН, с разной концентрацией Ni2 и диметилглиоксима. [8] |
Повышение щелочности до 5 - 10 - 2 М сопровождается улучшением формы кривой и увеличением максимального катодного тока. При дальнейшем увеличении концентрации едкого кали в растворе максимальный ток падает, уменьшается также площадь, ограниченная поляризационной кривой и линией остаточного тока, что свидетельствует об ухудшении условий концентрирования. Это вызвано, вероятно, тем, что возникающие в результате анодного процесса ионы никеля образуют в сильнощелочной среде достаточно растворимое соединение с диметилглиоксимом, которое не концентрируется на электроде. Тем не менее соединение никеля с диметилглиоксимом может быть получено на электроде даже из более щелочных растворов, если наряду с увеличением щелочности сдвигать потенциал электролиза в более положительную область. В этих условиях параллельно с процессом окисления никеля ( II) на электроде протекает реакция разряда гидроксильных ионов, приводящая к подкислению приэлектродного слоя. Интенсивность этой реакции, о которой можно судить по току электролиза, увеличивается с увеличением потенциала электрода, что компенсирует неблагоприятные условия среды. Малые количества никеля целесообразно концентрировать при потенциале 0 8 в из 0 02 - 0 06 М растворов едкого кали. Более щелочные растворы следует применять при относительно высоких содержаниях никеля ( 5 - 10 - 6 г-ион / л) и при анализе соединений амфотерных металлов. [9]
Страницы: 1