Прочность - связь - кислород
Cтраница 1
Прочность связи кислорода с поверхностью платины возрастает с повышением потенциала анода, что приводит к увеличению энергии активации ра спада поверхностных кислородных соединений и повышению перенапряжения кислорода. При потенциалах выше 2 0 В состояние поверхности платины меняется вследствие появления; хемосорбированных кислородных соединений радикального характера, образующихся дри разряде соответствующих анионов. [1]
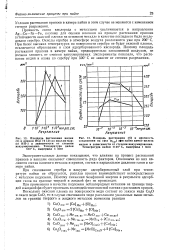 |
Площадь растекания индия / и припоя ПСр 72 ( 2 по никелю марки НП-2 в зависимости от степени вакуумирования. Температура пайки 850 С, выдержка 5 мин.| Площадь растекания ( S и прочность. [2] |
Прочность связи кислорода с металлами увеличивается в направлении Ag-Cu-Ni - Fe, поэтому для оценки влияния на процесс растекания припоев устойчивости окиснои пленки на основном металле в качестве последнего было исследовано серебро. Окислы серебра в атмосфере воздуха разлагаются уже при 200 С. При более высоких температурах на поверхности серебра не будет окиснои пленки, исключается образование и слоя адсорбированного кислорода. Поэтому площадь растекания припоев в камере пайки, предварительно заполненной воздухом, не должна зависеть от степени вакуумирования. Эксперименты показали, что растекание индия и олова по серебру при 500 С не зависит от степени разрежения. [3]
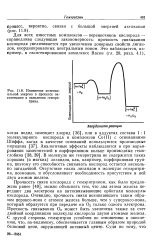 |
Изменение потенциальной энергии в процессе ок-сигенации и окисления гемэри-трина. [4] |
Прочность связи кислорода с гемэритрином, как было предложено ранее [40], можно объяснить тем, что два атома железа передают два электрона на антисвязывающие орбитали молекулы кислорода. Очевидно, прочность связи возникающего таким образом пероксо-иона с атомом железа больше, чем у супероксо-иона, который образуется при передаче на О2 только одного электрона. Прочность связывания О2 может быть увеличена также за счет двойной координации молекулы кислорода двумя атомами железа. С другой стороны, гемэритрин устойчив по отношению к окислению, что, по-видимому, обеспечивается главным образом природой белковой цепи, окружающей активный центр. [5]
 |
Кинетические характеристики глубокого окисления насыщенных кислот [ И5 ]. [6] |
Для характеристики прочности связи кислорода с поверхностью оксидного катализатора в разное время использовали различные величины: давление диссоциации оксидов при фазовых переходах, энтальпию образования оксидов из элементов, отнесенную к 1 моль кислорода, теплоту превращения низших оксидов в высшие, теплоту сорбции кислорода, восстанавливаемость оксидов, энергию активации изотопного обмена кислорода, скорость гомомолекулярного обмена кирло-рода и др. Из указанных величин первые три, связанные с фа-з овыми переходами оксидов, выбрали, исходя из представлений о том, что каталитическая реакция окисления в качестве промежуточных стадий включает переходы оксидов из одного фазового состояния в другое с различными валентными состояниями катионов. Сопоставление активностей оксидных катализаторов в реакциях глубокого окисления различных веществ со скоростями гомомолекулярного изотопного обмена кислорода на этих катализаторах выявляет достаточно четкие корреляции, однако некоторые оксиды ( например, оксид ванадия и оксид титана) выпадают из общей закономерности. [7]
 |
Кинетические характеристики глубокого окисления насыщенных кислот. [8] |
Для характеристики прочности связи кислорода с поверхностью оксидного катализатора в разное время использовали различные величины: давление диссоциации оксидов при фазовых переходах, энтальпию образования оксидов из элементов, отнесенную к 1 моль кислорода, теплоту превращения низших оксидов в высшие, теплоту сорбции кислорода, восстанавливаемость оксидов, энергию активации изотопного обмена кислорода, скорость гомомолекулярного обмена кислорода и др. Из указанных величин первые три, связанные с фа-з овыми переходами оксидов, выбрали, исходя из представлений о том, что каталитическая реакция окисления в качестве промежуточных стадий включает переходы оксидов из одного фазового состояния в другое с различными валентными состояниями катионов. Сопоставление активностей оксидных катализаторов в реакциях глубокого окисления различных веществ со скоростями гомомолекулярного изотопного обмена кислорода на этих катализаторах выявляет достаточно четкие корреляции, однако некоторые оксиды ( например, оксид ванадия и оксид титана) выпадают из общей закономерности. [9]
В качестве меры прочности связи кислорода в исследованных солях нами использованы величины энергии активации процесса изотопного обмена и удельный обмен - степень обмена ( в %), достигнутая при определенной температуре за известный промежуток времени, отнесенная к 1 м2 поверхности соли. В табл. 3 представлены соответствующие цифры. [10]
Проанализированы взаимоотношения между прочностью связи кислорода ( 7s) с поверхностью металлов и окислов и их каталитической активностью в отношении окисления водорода, окиси углерода, аммиака и сернистого газа. Во всех случаях ( за исключением окисления SO2 на окислах) зависимость каталитической активности от qs выражается характерными кривыми с максимумом, положение которого определяется принципом энергетического соответствия. При окислении сернистого газа на окислах значение qs для наиболее активного катализатора ( V2O5) существенно отличается от ( qs) опт, рассчитанного теоретически. Это объясняется тем, что VjOs не является истинным оптимальным катализатором данной реакции; окислы, qs для которых близко к ( fs) oni ( СозО4, MnC2, NiO), неустойчивы в условиях сернокислотного катализа. Проведено также сопоставление термодинамических свойств веществ и их каталитической активности в отношении окисления хлористого водорода. [11]
Проанализированы взаимоотношения между прочностью связи кислорода с поверхностью металлов и окислов ( qs) и их каталитической активностью в отношении полного окисления парафинов, циклопарафинов, олефинов, ацетиленовых и ароматических углеводородов, метанола и некоторых других веществ. [12]
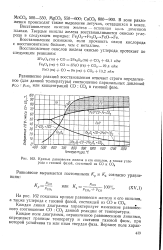 |
Кривые равновесия железа и его окислов, а также углерода с газовой фазой, состоящей из СО и СО3. [13] |
Восстановление возможно, если прочность связи кислорода с восстановителем больше, чем с металлом. [14]
Восстановление возможно, если прочность связи кислорода с восстановителем больше, чем с металлом. [15]
Страницы: 1 2 3 4