Свойство - бром
Cтраница 1
Свойства брома, в том числе и его коррозионное воздействие на конструкционные и иные материалы, существенно зависят от количества и природы содержащихся в нем примесей. Высказано мнение [406], что с появлением более эффективных способов очистки, чем существующие в настоящее время, бром найдет много новых важных практических применений. [1]
Это свойство брома и послужило поводом к его открытию: было замечено бурое окрашивание при прибавлении хлорной воды к тому рассолу, который остается после осаждения из морской воды поваренной соли; при нагревании получились бурые пары, превратившиеся при охлаждении в зловонную краснобурую жидкость. [2]
В книге описываются свойства брома и иода и источники сырья для их получения. Описаны также методы производства наиболее важных соединений брома и иода. [3]
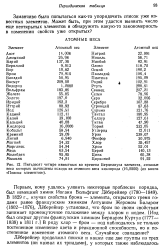 |
Пятьдесят четыре известных во времена Берцелиуса элемента, атомные веса которых вычислены исходя из атомного веса кислорода ( 16 0000 ( из книги Поиски элементов. [4] |
В 1829 г., изучая свойства брома - элемента, открытого тремя годами ранее французским химиком Антуаном Жеромом Баларом ( 1802 - 1876), Деберейнер установил, что бром по своим свойствам занимает промежуточное положение между хлором и иодом. Иод был открыт другим французским химиком Бернаром Курту а ( 1777 - 1838) в 1811 г. ] В ряду хлор - бром - иод наблюдалось не только постепенное изменение цвета и реакционной способности, но и постепенное изменение атомного веса. [5]
Группа CNS подобно циану обладает свойствами кислотного остатка, напоминая свойства брома или иода, и существует в свободном состоянии в форме NCS - SCI Это химическое соединение называется роданом. [6]
Второе издание ( 1 - е - 1979 г.) переработано с учетожрациональных нововведений в отрасли. Описаны свойства брома, иода и их наиболее важных неорганических и органических соединений, определяющие технологию и способы их получения. Рассмотрены физико-химические основы технологии указанных продуктов при переработке морской воды, ее концентратов, а также озерных и подземных минерализованных вод и твердых соляных отложений. Уделено внимание созданию комплексной, безотходной переработки гидроминерального сырья. Обобщен опыт отечественной и зарубежной иодобромной промышленности. [7]
Если при двойной связи имеются два разных а-положения, как, например, в СН3СН СНСН2СН3, водород у вторичного атома углерода замещается легче, чем у первичного. Благодаря элект-роноакцепторным свойствам брома второй атом брома легче присоединяется с другой стороны двойной связи, а не в а-по-ложение к первому атому брома. [8]
В воде йод растворяется очень плохо, но, как и бром, хорошо растворяется в органических растворителях. Этим свойством брома и йода пользуются для их извлечения ( экстрагирования) из водных растворов больших объемов. При этом раствор брома или йода в органическом растворителе всплывает на поверхность воды и и отделяется от нее с помощью делительной воронки простым сливанием. [9]
 |
Ход функции AFH - - / ( r для диссоциации молекул галогенов. [10] |
Особенность повышения сродства к электрону у С1 по сравнению с F напоминает об особенности ионизационного потенциала калия. На свойствах брома и иода отражается их положение в нижней части Системы; появляются большие координационные числа, сложные гибридные состояния и большое разнообразие степеней окисления. [11]
Атом брома, как и атом хлора, имеет в своей наружной электронной оболочке 7 валентных электронов. Такое одинаковое построение внешней электронной оболочки обусловливает большое сходство многих свойств брома и хлора. Как и хлор, бром является весьма энергичным элементом. В природе встречается только в виде своих соединений. Бром является сильным окислителем и типичным неметаллом. Однако все эти свойства у него выражены слабее, чем у хлора. Это объясняется тем, что атом брала содержит большее число электронов вокруг ядра, имеет большее число электронных оболочек, его валентные электроны более удалены от ядра и менее с ним связаны, чем у атома хлора. Способность атомов брома присоединять к внешней оболочке восьмой электрон выражена меньше, чем у атомов хлора. Эти соединения содержатся в небольшом количестве а морской воде, в воде некоторых озер, а также находятся в виде примесей в различных природных отложениях. [12]
Бромирование ароматических аминов происходит лишь в незанятых орто - и пара-положениях к аминогруппе. Метод определения аминов бромированием не получил широкого распространения, так как возможны различные помехи, обусловленные окислительными и замещающими свойствами брома. [13]
В каждой группе периодической системы элементов первый ее член характеризуется наличием у атома только четырех орби-талей, в то время как атомы остальных элементов помимо s - и р-орбиталей могут использовать также с ( - орбитали. Вследствие этого наибольшие различия наблюдаются в химии первого и последующих элементов группы. Кроме того, свойства иода заметно отличаются от свойств брома и хлора, так что между крайними членами группы галогенов фтором и иодом можно обнаружить лишь незначительное химическое сходство. [14]
Присоединяя один электрон, хлор завершает свой наружный уровень и приобретает электронную конфигурацию инертного газа аргона. Далее, 3s - и Зр-электроны могут участвовать в образовании донорной связи с электронодефицитными веществами; возможно, кроме того, образование дативных связей за счет вакантных Зо. Поэтому хлорид-ион легко образует хлоридные комплексы со многими ионами металлов. Это может также привести к образованию атомами хлора мостиков в комплексах и к образованию полиядерных комплексов, особенно в случае металлов, имеющих заполненные или почти заполненные d - орбитали. Эти свойства хлора аналогичны свойствам брома, но выражены слабее. Поэтому хлориды однозарядных ионов Ag, Cu, Hg, BiO и SbO растворимы не так плохо, как бромиды. [15]
Страницы: 1