Скорость - разложение - перекись
Cтраница 1
Скорость разложения перекиси трет. [1]
Скорость разложения перекиси на свободные радикалы зависит от температуры. Взаимодействие свободных радикалов с полимером протекает быстрее, и поэтому реакция разложения определяет скорость процесса. Продолжительность вулканизации при различных температурах рассчитывают по графику аналогичному тому, который приведен на рис. 7.3. При условии, что высокие температуры не оказывают иного влияния, кроме ускорения разложения перекиси, свойства материалов, вулканизованных при различных температурах, должны быть в общем одинаковыми. [2]
Скорость разложения перекиси недорода на поверхности обык-нонешюго л активированного сахарного угля, окиси железа, гидроокиси магния, кколина, трехокиси нольфрама, стекла, трех-хлористою хрома, окиси цинка, окиси серебра и силикнгеля может быть изменена в ту или другую сторону путем добавки небольших количеств кислоты или щелочи. [3]
Скорость разложения перекиси ацетила зависит от растворителя. [4]
Зависимость скорости разложения перекисей алифатических кислот от их строения ясно указывает, что процессы разрыва О - О-связи и р-фрагментации могут быть синхронными. [5]
Скорость полимеризации определяется скоростью разложения перекисей в растворителе. [6]
Тот факт, что скорость разложения перекиси зависит только от температуры, позволяет перерабатывать эти материалы литьем под давлением ( шприцеванием) при высоких температурах и с коротким циклом вулканизации. Общая продолжительность цикла снижается благодаря использованию максимально допустимых температур цилиндра и сопла, не вызывающих разложения перекиси. Температура может меняться от 60 до 90 С; во втором случае общая продолжительность цикла значительно ниже, чем в первом. Большое значение имеет и температура формы. Так, при 200 С продолжительность вулканизации составляет всего 2 мин. [7]
Из температурного коэффициента константы скорости разложения перекиси трет. Как видно из этих значений, их различие не превосходит погрешности в определении этих величин. [8]
Из сравнения значений констант скорости разложения перекиси триметилкремнпя и трет. С скорости их превращения мало различаются. Все же перекись триметилкремния при этой температуре разлагается в два раза медленнее, чем перекись трет, бутила. [9]
При изучении влияния растворителя на скорость разложения перекиси бензоила был обнаружен взрывной характер ее взаимодействия с третичными ароматическими аминами. В среде мономера при небольших концентрациях инициирующих компонентов, взятых в стехиометрических количествах, эта реакция может быть использована для инициирования полимеризации при комнатной температуре. [10]
При изучении влияния растворителя на скорость разложения перекиси бензоила был обнаружен взрывной характер ее взаимодействия с третичными ароматическими аминами. В среде мономера при небольших концентрациях инициирующих компонентов, взятых в стехиометрических количествах, эта реакция может быть использована для инициирования полимеризации при комнатной температуре. [11]
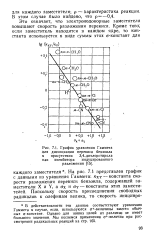 |
График уравнения Гаммета для диссоциации перекиси бензоила в присутствии 3 4-дихлорстирола как ингибитора индуцированного разложения. [12] |
Это означает, что электронодонорные заместители повышают скорость разложения перекиси. [13]
Продукты, имеющие щелочную реакцию, также влияют на скорость разложения перекиси. В этом случае перекиси, содержащие кислотные группы, разрушаются особенно легко, напротив, перекиси, не содержащие кислотных групп, несколько менее чувствительны к действию ингредиентов резиновой смеси щелочного характера. [14]
Во второй фазе окисления, соответствующей автокаталитическому развитию процесса, скорость разложения перекиси возрастает и, наконец, становится равной скорости ее образования. После достижения максимальной величины процесс самоокисления замедляется. [15]
Страницы: 1 2 3