Скорость - растворение - титан
Cтраница 1
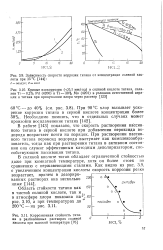
Скорость растворения титана в пассивной области практически не зависит от потенциала и резко возрастает при повышении концентрации плавиковой кислоты. Скорость коррозии сплава при f 0 7в линейно возрастает в интервале концентраций плавиковой кислоты 1 0 - 2 5 н, как будто растворение сплава ъ области перепассивации является реакцией первого порядка по плавиковой кислоте. [1]
 |
Зависимость скорости. [2] |
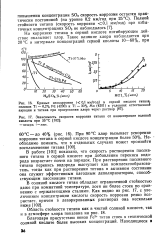
Скорость растворения титана в активном состоянии во всех исследованных растворах растет при понижении рН растворов. [3]
 |
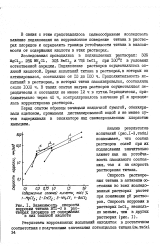
Коррозия металлов в контакте с титаном в морской воде при различном соотношении поверхностей металл SMe. титан STI. продолжительность испытаний 2500 ч. [4] |
На скорость растворения титана в азотной кислоте не влияет контакт с другими металлами. [5]
Уменьшения скорости растворения титана при смещении анодного потенциала электрода в положительную сторону при низких частотах, как это наблюдалось в растворах серной кислоты, в данном случае не происходит, так как присутствующие в растворе ионы хлора, очевидно, препятствуют образованию на поверхности металла сплошной пассивирующей окисной пленки. Если при прочих равных условиях сравнить коррозионные эффекты на титане в 10 N растворе H2S04 и в 10 N растворе HG1 при одних и тех же значениях анодного потенциала ( см. рис. 3 и 5), то оказывается, что скорость растворения титана в 10 N НС1 значительно выше ( особенно при низких частотах), чем в серной кислоте той же концентрации. [6]
Сопоставление скорости растворения титана при стационарном потенциале со скоростью растворения при потенциалах в области устойчивой пассивности показывает, что анодная защита позволяет снизить скорость коррозии в 15 - 30 раз. Плотность анодного тока в данном случае не может служить количественной характеристикой коррозионного процесса, поскольку одновременно осуществляется процесс анодного окисления ионов Сг2 до Сг3, скорость которого в 85 раз превышает скорость растворения титана в области устойчивой пассивности. [7]
Характер зависимости скорости растворения титана от концентрации серной кислоты имеет сложный характер. [8]
Испытано влияние различных веществ на скорость растворения титана и его сплавов в этих растворах. Предложено несколько термически и химически стойких в азотной кислоте веществ - эффективных ингибиторов коррозии этих металлов, уменьшающих ее в описанных условиях в 20ч - 100 раз. [9]
В работе [143] показано, что скорость растворения пассивного титана в серной кислоте при добавлении пероксида водорода возрастает почти на порядок. При растворении пассивного титана пероксид водорода выступает как комплексообра-зователь, тогда как при растворении титана в активном состоянии она служит эффективным катодным деполяризатором, способствующим пассивации титана. [11]
В работе [101] показано, что скорость растворения пассивного титана в серной кислоте при добавлении перекиси водорода возрастает почти на порядок. При растворении пассивного титана перекись водорода выступает как комплексообразова-тель, тогда как при растворении титана в активном состоянии она служит эффективным катодным деполяризатором, способствующим пассивации титана. [13]
В присутствии даже небольших количеств ионов фтора скорость растворения титана увеличивается [85, 86], что наблюдается также и на электродах из гидрида титана. [14]
Показано, что в 10 N растворе НС1 скорость растворения титана под действием переменного тока при всех исследованных частотах значительно выше, чем в серной кислоте той же концентрации, что объясняется активирующим действием хлор-ионов. [15]
Страницы: 1 2 3