Скорость - реакция
Cтраница 1
 |
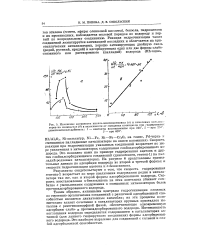
Типичные кривые зависимости концентрации от времени, при помощи которых можно получить кинетические данные. [1] |
Скорость реакции в любой момент времени определяют по тангенсу угла наклона кривой в данной точке - Затем для нахождения зависимости между наблюдаемой скоростью реакции и экспериментальными переменными проводят соответствующую математическую обработку результатов. [2]
Скорость реакции эквивалентна числу активированных комплексов, проходящих через энергетический барьер за единицу времени. [3]
Скорость реакций сильно зависит от температуры и давления паров воды. [4]
Скорость реакции на катализаторе выразим, в простейшем случае, через равновесную поверхностную концентрацию или заполнение реагирующего компонента. [5]
Скорость реакции на катализаторе не зависит от объемной концентрации. В этом случае изменение концентрации у поверхности, чем бы это ни вызывалось, не изменяет скорости реакции, и, следовательно, диффузионное торможение переноса реагентов не влияет на скорость реакции. [6]
Скорость реакции имеет первый порядок по кислороду и порядок 0 5 по пиридину. [7]
Скорость реакции увеличивается с ростом температуры. [8]
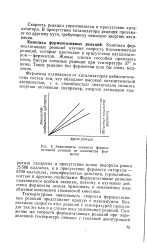 |
Зависимость скорости ферментативной реакции от количества фермента. [9] |
Скорость реакции увеличивается в присутствии катализатора. В присутствии катализатора реакция протекает по другому пути, требующему меньшую энергию активации. [10]
Скорость реакции растет с увеличением частоты встряхивания реактора до критического предела, когда процесс не лимитируется диффузией. [11]
Скорость реакции при гидрогенизации указанных соединений возрастает по мере увеличения в катализаторах содержания слабоадсорбированного водорода. Это показано нами на примере гидрирования ацетона и других слабоадсорбирующихся соединений ( циклогексен, гептен-1) на палладий-родиевых катализаторах. На рисунке 6 представлены сравнительные данные по адсорбции водорода во второй и третьей формах и скорости гидрогенизации ацетона и и-бензохинона. [13]
Скорость реакции в интервале концентраций ионов хлора 0 5 - 3 7 и ионов водорода 0 05 - 0 22 г-ион / л подчиняется кинетическому уравнению второго порядка: первого по я-аллилпалладийхлориду и первого по п-бензохи-нону. [15]
Страницы: 1 2 3 4