Уилмарт
Cтраница 1
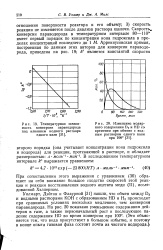 |
Температурная зависимость конверсии параводорода под влиянием водного раствора едкого кали.| Изменение молярного содержания D2 и HD со временем при обмене с водным раствором едкого кали при 100. [1] |
Уилмарт, Дэйтон и Флаурной [31] нашли, что обмен между D2 и водными растворами КОН с образованием HD и Н2 происходит при сравнимых условиях несколько медленнее, чем конверсия параводорода. Это объясняется тем, что вода присутствует в большом избытке, и поэтому в конце опыта газовая фаза состоит почти из чистого водорода. [2]
Уилмарт и его сотрудники нашли, что если проводить обмен в lOAf серной кислоте при 120, то даже после 5 час. Однако, как показывает сопоставление уравнений ( 43) и ( 44), характер разрываемых и вновь образуемых связей у реагентов ( кроме D-D) в обоих случаях сильно различен. Поэтому авторы настоящего обзора не видят причины, по которой в условиях обмена, катализируемого основаниями, должен обязательно происходить обмен, катализируемый кислотами, хотя последний при достаточно жестких условиях и может иметь место. [3]
Уилмарт и Дейтон 15 заметили, что процесс конверсии параводорода в ортоводород. [5]
Уилмарт и Барш [3] детально изучили конверсию орто-пара-водорода под влиянием растворов ацетата меди ( 1) в хинолине с целью установления связи между реакциями конверсии и гидрирования. [6]
Уилмарт и Барш [3] детально изучили конверсию орто-пара-водорода под влиянием растворов ацетата меди ( 1) IB хинолине с целью установления связи между реакциями конверсии и гидрирования. [7]
Уилмарт и Барш провели также сравнение между скоростью восстановления двухвалентных ионов меди и скоростью орто-пара конверсии водорода. Они установили близкое соответствие между скоростями этих реакций в условиях, когда в качестве катализатора применялся ацетат меди ( 1), что, по мнению авторов, является экспериментальным доказательством образования в обеих реакциях одинаковых активированных промежуточных веществ. [8]
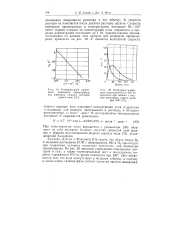 |
Температурная зависимость конверсии параводорода под влиянием водного раствора едкого кали.| Изменение молярного содержания D и HD со временем при обмене с водным раствором едкого кали при 100. [9] |
Уилмарт, Дэйтон и Флаурной [31] нашли, что обмен между D2 и водными растворами КОН с образованием HD и Н2 происходит при сравнимых условиях несколько медленнее, чем конверсия параводорода. Это объясняется тем, что вода присутствует в большом избытке, и поэтому в конце опыта газовая фаза состоит почти из чистого водорода. [10]
Уилмарт и Барш провели также сравнение между скоростью восстановления двухвалентных ионов меди и скоростью ортснпара конверсии водорода. Они установили близкое соответствие - между скоростями этих реакций в условиях, когда в качестве катализатора применялся ацетат меди ( 1), что, по мнению авторов, является экспериментальным доказательством образования в обе: их реакциях одинаковых активированных промежуточных веществ. [11]
Уилмарт и его сотрудники нашли, что если проводить обмен в 10 Af серной кислоте при 120, то даже после 5 час. Однако, как показывает сопоставление уравнений ( 43) и ( 44), характер разрываемых и вновь образуемых связей у реагентов ( кроме D-D) в обоих случаях сильно различен. Поэтому авторы настоящего обзора не видят причины, по которой в условиях обмена, катализируемого основаниями, должен обязательно происходить обмен, катализируемый кислотами, хотя последний при достаточно жестких условиях и может иметь место. [12]
Уилмарт и Шварц [43] определили ряды изменения констант равновесия и констант скоростей образования геара-замещенныха а-дифенил - 3-бензоил-р - гидразилов из тетразанов в растворе ацетона при различных температурах, что позволило вычислить энергии и энтропии реакции и активации. X X Ю3 Дж / моль), а энтропия, как и следует ожидать для реакций дис-социации, сильно возрастает. Дж / моль), а энтропия активации гомолиза имеет небольшую отрицательную величину, поскольку обычно энтропия активации не учитывает изменения энтропии по координате реакции ( гл. Дж / моль) и что энтропия активации для этого процесса является сильно отрицательной, что обычно и наблюдается для реакций ассоциации ввиду значительных потерь в поступательной и вращательной энтропии. Основной причиной, обусловливающей сам факт наличия энергии активации процесса коллигации, является необходимость создания некоторой предварительной концентрации спиновой плотности на коллигирующихся атомах азота; на этот процесс оказывают влияние соседний атом азота и заместители. Влияние растворителя [40] на эти равновесные процессы будет значительно более сильным, чем влияние растворителя на равновесие гомолиза гексафенилэтана до трифенилметила ( разд. [13]
В дальнейшем Уилмарт с сотрудниками более подробно изучили как систему амидный ион - жидкий аммиак, так и систему ион гидроксила - вода. Уилмарт, Дэйтон и Флаурной [31] провели кинетическое исследование орто-щара-конверсии водорода и обмена D2 - Н2О в системе КОН-Н2О и впервые установили, что реакция катализируется гомогенно. [14]
В дальнейшем Уилмарт с сотрудниками более подробно изучили как систему амидный ион - жидкий аммиак, так и систему ион гидроксила - вода. Уилмарт, Дэйтон и Флаурной [31] провели кинетическое исследование ортенпара-конверсии водорода и обмена D2 - Н2О в системе КОН-Н2О и впервые установили, что реакция катализируется гомогенно. [15]
Страницы: 1 2 3
