Валентные уровни
Cтраница 1
Валентные уровни, содержащие пять или более электронных пар, среди которых могут быть неподеленные пары, необходимо исследовать подробнее. Вначале рассмотрим пять электронных пар. Выше было показано, что пять пар допускают конфигурацию три-гональной бипирамиды, и поэтому молекулы АХ5 должны иметь эту стереохимическую форму. L - представляет собой неподеленную пару, будут иметь две возможные конфигурации, или изомерные формы. Это обстоятельство возникает из неэквивалентности полярного и экваториального положений в тригональной бипирамиде, так как неподеленная пара, занимающая полярное положение, образует угол 90 с каждой из трех экваториальных связывающих пар и угол 180 с полярной связывающей парой. Если неподеленная пара занимает экваториальное положение, то ясно, что она расположена под углом 120 к каждому из двух других экваториальных положений и под углом 90 к каждому из полярных положений. Поэтому в вышерассмотренном примере ( молекула AXtL), структуре, в которой L находится в экваториальном положении с образованием угла 90 только с двумя связывающими парами, и следует отдать предпочтение перед структурой, имеющей L в полярном положении с углами 90 по отношению к трем связывающим парам. [1]
Валентные уровни, содержащие пять или более электронных пар, среди Которых могут быть неподеленные пары, необходимо исследовать подробнее. Вначале рассмотрим пять электронных пар. Выше было показано, что пять пар допускают конфигурацию три-гональной бипирамиды, и поэтому молекулы АХ5 должны иметь эту форму. L представляет собой неподеленную пару, будут иметь две возможные конфигурации, или изомерные формы. Это обстоятельство возникает из неэквивалентности полярного и экваториального положений в тригональной би-пирамиде, так как неподеленная пара, занимающая полярное положение, образует угол 90 с каждой из трех экваториальных связывающих пар и угол 180 с полярной связывающей парой. Если неподеленная пара занимает экваториальное положение, то ясно, что она расположена под углом 120 к каждому из двух других экваториальных положений и под углом 90 к каждому из полярных положений. [2]
Валентные уровни, содержащие пять или более электронных пар, среди которых могут быть неподеленные пары, необходимо исследовать подробнее. Вначале рассмотрим пять электронных пар. Выше было показано, что пять пар допускают конфигурацию три-гональной бипирамиды, и поэтому молекулы АХ5 должны иметь эту стереохимическую форму. L - представляет собой неподеленную пару, будут иметь две возможные конфигурации, или изомерные формы. Это обстоятельство возникает из неэквивалентности полярного и экваториального положений в тригональной бипирамиде, так как неподеленная пара, занимающая полярное положение, образует угол 90 с каждой из трех экваториальных связывающих пар и угол 180 с полярной связывающей парой. Если неподеленная пара занимает экваториальное положение, то ясно, что она расположена под углом 120 к каждому из двух других экваториальных положений и под углом 90 к каждому из полярных положений. L находится в экваториальном положении с образованием угла 90 только с двумя связывающими парами, и следует отдать предпочтение перед структурой, имеющей L в полярном положении с углами 90 по отношению к трем связывающим парам. Это предсказание подтверждается структурами молекул A. [3]
Валентные уровни, содержащие пять или более электронных пар, среди которых могут быть неподеленные пары, необходимо исследовать подробнее. Вначале рассмотрим пять электронных пар. Выше было показано, что пять пар допускают конфигурацию три-гональной бипирамиды, и поэтому молекулы АХ5 должны иметь эту стереохимическую форму. Молекулы же AX4i, где L - представляет собой неподеленную пару, будут иметь две возможные конфигурации, или изомерные формы. Это обстоятельство возникает из неэквивалентности полярного и экваториального положений в тригональной бипирамнде, так как неподеленная пара, занимающая полярное положение, образует угол 90 с каждой из трех экваториальных связывающих пар и угол 180 с полярной связывающей парой. Если неподеленная пара занимает экваториальное положение, то ясно, что она расположена под углом 120 к каждому из двух других экваториальных положений и под углом 90 к каждому из полярных положений. L находится в экваториальном положении с образованием угла 90 только с двумя связывающими парами, и следует отдать предпочтение перед структурой, имеющей L в полярном положении с углами 90 по отношению к трем связывающим парам. [4]
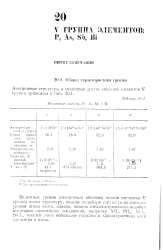 |
Некоторые свойства Р, As, Sb и Bi. [5] |
Валентные уровни электронных оболочек атомов элементов V группы имеют структуру, внешне подобную структуре валентного уровня атома азота, однако, помимо стехиометрического подобия некоторых простейших соединений, например NH: i, PH. [6]
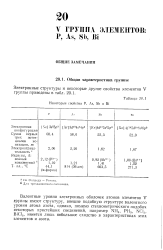 |
Некоторые свойства Р, As, Sb n Bi. [7] |
Валентные уровни электронных оболочек атомов элементов V группы имеют структуру, внешне подобную структуре валентного уровня атома азота, однако, помимо стехиометрического подобия некоторых простейших соединений, например NH3, PH3, NCL, BiCl3, имеется лишь небольшое сходство в характеристиках этих элементов и азота. [8]
 |
Оси координат для молекул в 17. [9] |
При нумерации валентных уровней учитываются лишь валентные атомные орбитали, чтобы в явной форме выступала корреляция уровней однотипных соединений. В связи с этим внесены очевидные изменения в нумерации уровней некоторых оригинальных работ, где при нумерации учитывались - внутренние энергии. [10]
До сих пор были рассмотрены валентные уровни, в которых электронные пары участвуют в ординарных связях между идентичными атомами или группами. [11]
До сих пор были рассмотрены валентные уровни, в которых электронные пары участвуют в ординарных связях между идентичными атомами или группами. [12]
Наблюдается систематическое повышение энергий всех валентных уровней и внутреннего уровня элемента А в соединениях АХпу -, где А - элементы одного периода. [13]
Только зона, образованная от валентных уровней, может оказаться в ряде случаев заполненной неполностью. Зону, произошедшую от валентных уровней атомов, образующих кристалл, называют валентной зоной. [14]
Согласно предложенной модели связей, выше валентных уровней, соответствующих образованию двухэлектронных ко-валентных связей Me - Si, должны находиться три Зй-уровня и два 4р - уровня металлических атомов. Поскольку именно эти уровни, по нашему мнению, ответственны за электрофизические характеристики соединений, представляет интерес знание их взаимного энергетического расположения. [15]
Страницы: 1 2 3 4