Чистая фаза
Cтраница 1
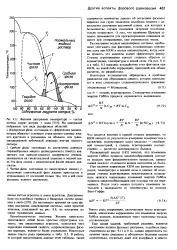 |
Фазовая диаграмма температура - состав системы лаурат натрия вода. На диаграмме изображены три вида двухфазных областей. [1] |
Чистая фаза, состоящая из ламеллярных мицелл с, аналогичная смектической фазе жидких кристаллов и отличающаяся от последней только тем, что в ней слои разделены водным раствором. [2]
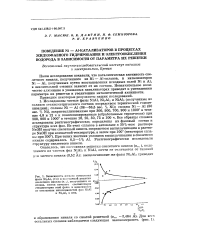 |
Зависимость осевого отношения JW фазы Ni2Al3 ( с / а и постоянной решетки скелетного никеля ( ОпЛ, полученного и5 ttc J. [3] |
Исследованы чистые фазы NiAl, Ni2Als и NiAl3 ( полученные из сплавов стехиометрического состава посредством термической гомогенизации); сплавы Ni - А1 ( 38 - 68 5 вес. [4]
 |
Ферромагнитные окислы с гексагональной решеткой, содержащие элементы структуры типа шпинели [ 1911. [5] |
Получение чистых фаз представляет собой чрезвычайно трудную задачу, так как благодаря их сходству часто наблюдается одновременное срастание нескольких соединений в одном кристалле, а области твердого раствора или усредненных структур при комнатной температуре не существуют. То, что это соединение является строго стехиометри-ческим, было доказано голландскими учеными. Им удалось получить химические, структурные и магнитные характеристики всей системы, которую из-за отсутствия в то время аппаратуры для дифракционных измерений с высокой разрешающей способностью вполне можно было принять за область одной фазы с широким интервалом составов, каковой она и выглядела при высоких температурах. [6]
ОТНОСятся к чистым фазам. [7]
Верхний индекс 0 обозначает чистые фазы при тех же температуре и давлении. При этом предполагалось, что литиевый электрод и хлорид таллия являются чистыми фазами. Равенство ( 20 - 4) определяет вторичное стандартное состояние для таллия в амальгаме таллия, а именно состояние чистого таллия. [8]
Систему, в которой твердая чистая фаза находится в равновесии с насыщенным раствором, можно рассматривать с двух точек зрения. Если твердая фаза - растворитель ( компонент /), выделившийся из раствора, в котором его концентрация относительно велика, то равновесная температура называется точкой замерзания раствора данного состава при данном давлении. Когда нет необходимости различать растворитель и растворенное вещество, обычно говорят о точке замерзания. Именно в этом смысле рассматривались точки ветвей ликвидуса на диаграммах плавкости систем, образованных нерастворимыми в твердом состоянии компонентами ( гл. [9]
Систему, в которой твердая чистая фаза находится в равновесии с насыщенным раствором, можно рассматривать с двух точек зрения. Если - твердая фаза - компонент 2, выделившийся из раствора, в котором его содержание мало, то равновесная концентрация раствора является растворимостью компонента 2 при данных Тир. Если твердая фаза - растворитель ( компонент /), выделившийся из раствора, в котором его концентрация относительно велика, то равновесная температура называется точкой замерзания раствора данного состава при данном давлении. Когда нет необходимости - различать растворитель и растворенное вещество, обычно говорят о точке замерзания. Именно в этом смысле рассматривались точки ветвей ликвидуса на диаграммах плавкости систем, образованных нерастворимыми в твердом состоянии компонентами ( гл. [10]
Верхний индекс О обозначает чистую фазу I. Уравнение (10.83) следует из определения активности, величина которой равна концентрации только в идеальном растворе. [11]
Необходимость производить измерения в чистой фазе имеет особое значение при определении расхода водяного пара или жидкости с температурой, близкой к точке кипения. Важно также, чтобы газ не был носителем твердых или жидких веществ в распыленном состоянии. Если эти условия не выполнены, при измерениях могут возникать отклонения, которые нельзя оценить расчетами, тогда остается только определить характеристику расхо-домерного устройства экспериментальным путем. Особенно сильные искажения в характеристиках расходомерных устройств могут получиться при измерении расхода газов и паров в состоянии, близком к границе сжижения. Поэтому рекомендуется проверять, не вызывает ли изменение давления при измерениях конденсацию, искажающую показания приборов, кроме того, протекающая среда должна полностью заполнять все объемы расходомерного устройства. [12]
Для растворителей стандартным состоянием остается чистая фаза растворителя. За стандартное состояние растворенных веществ принимается уже упоминавшееся выше гипотетическое идеальногазовое состояние данного растворенного вещества в исследуемом растворителе. При этом предполагается, что парциальные энтальпия, объем и теплоемкость растворенного вещества в этом стандартном состоянии имеют такую же величину, как в бесконечно разбавленном растворе. Значение коэффициента активности у 1 для какого-либо состояния раствора как раз и свидетельствует, что в этом состоянии нет отступлений в свойствах раствора от идеального раствора. Можно наглядно представить себе стандартное состояние растворенного вещества, если на основе принципа термодинамической допустимости воспользоваться воображаемой со-фазой ( см. стр. Но энергия взаимодействия частиц разных растворенных веществ с растворителем различна, и поэтому для каждого случая пришлось бы вводить в рассмотрение особый вариант со-фазы, что делает такой подход не столь уже привлекательным. [13]
Растворы более неупорядоченны, чем чистые фазы вещества. Поэтому реакции, приводящие к растворению одного вещества в другом, обычно имеют положительные значения величин AS. И наоборот, появление в результате реакции чистой конденсированной фазы, например выпадение осадка, обычно означает, что величина AS для этой реакции отрицательна. [14]
Рассмотрим плоскую границу раздела двух чистых фаз А и В; свойства границы раздела охарактеризуем величиной поверхностного натяжения о, измеряемой в единицах силы на единицу длины. [15]
Страницы: 1 2 3 4