Ионный характер - связь
Cтраница 1
Ионный характер связи возрастает у элементов, расположенных левее железа, отличающихся менее достроенной d - оболочкой. Соответственно увеличивается и прочность связи, обусловливающая более высокую стабильность карбидной составляющей. [2]
Ионный характер связи анион-металл, а следовательно, и существование самого аниона подтверждается данными электропроводности. Циклопентадиенильный анион легко реагирует с электро-фильными реагентами: например, его соли карбилируются двуокисью углерода, подобно фенолу. [3]
Ионный характер связи анион-металл, а следовательно, и существование самого аниона подтверждается данными электропроводности. [4]
Ионный характер связи и частота ЯКР коррелируются также с разностью электроотрицательностей атомов, участвующих в образовании связи. [5]
Ионный характер связи подразумевает и относительную неизменность анионов в рядах, например, солей щелочных металлов. Действительно, неизменность в первом приближении анионов типа - О. Точно также спектры перренатов щелочных элементов L23J и фторалюмината лития и натрия [ 24J совпадают со спектрами соответствующих ионов в растворах. [6]
Ионный характер связи нередко является причиной значительной нежесткости молекулярного состава, которая в большой степени затрудняет описание структуры в терминах равновесной геометрической конфигурации. [7]
Ионный характер связи дает для дипольного момента величину, которая зависит не только от различий в размерах атомов, участвующих в образовании связи ( гомеополярный диполь), но и от других условий. Этими условиями являются прежде всего: асимметрия распределения плотности связывающих электронов, асимметрия АО, участвующих в образовании связи, и поляризация несвязывающих электронов. [8]
Ионный характер связи проявляется различным образом. [9]
Ионный характер связей в трифторидах, в особенности в три-фторидах платиновых металлов, выражен менее резко, чем в ди-фторидах. В высших фторидах платиновых металлов связи имеют преимущественно ковалентный характер, и эти соединения легко испаряются. [10]
Ионный характер связи проявляется, в частности, в том, что многие соли, например галоидные соли щелочных металлов, растворяются в полярных растворителях, диссоциируя на ионы. Однако факт отсутствия растворимости не может еще служить доказательством наличия у соединения неполярной связи. Так, энергия связи, например, у окислов настолько больше энергии связи щелочных га-логенидов, что диэлектрическая постоянная воды уже недостаточна для отрыва ионов от кристалла. [11]
 |
Свойства металлов главной подгруппы I группы. [12] |
Ионный характер связей в гидроксидах и солях и способность ионов к гидратации обусловливают высокую степень диссоциации этих соединений в растворах и наличие ионов в твердых фазах. По мере перехода от лития к цезию ( франций мало изучен) с ростом радиуса атома наблюдается увеличение числа молекул воды, гид-ратирующих ион в растворе, понижение энергии гидратации ( как следствие убыли отношения заряд / радиус), понижение энергии образования кристаллических решеток солей, а также температур плавления металлов. Понижение ионизационного потенциала соответствует и росту химической активности по отношению к реакциям окисления в ряду литий - цезий. Цезий и рубидий воспламеняются на воздухе, тогда как литий на воздухе сравнительно устойчив. [13]
Ионный характер связей максимально выражен у некоторых окислов, например у закиси меди Си2О, используемой для изготовления купроксных выпрямителей. Чисто ионным характером связей не обладает ни одно из вышеназванных полупроводниковых соединений. [14]
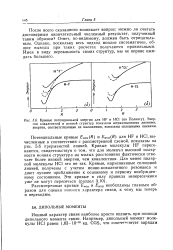 |
Кривые потенциальной энергии для HF и НС1 ( по Полингу. Энергии ковалентной и ионной структур показаны штрихованными линиями. энергии, соответствующие их наложению, показаны сплошными линиями. [15] |
Страницы: 1 2 3 4
