Энергия - активация - распад
Cтраница 1
Энергия активации распада первых составляет десятки, вторых - единицы ккал / моль. Поэтому здесь сразу же возникает специфический для полимеров вопрос: разрывы каких связей ( внутримолекулярных или межмолекулярных) определяют ход разрушения полимера в тех или иных условиях. [1]
 |
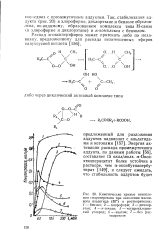
Границы области взрывного разложения перекиси этила в координатах р - Т ( 1 и. [2] |
Энергия активации распада была найдена равной 21 ккал / молъ. Далее было констатировано, что при повышении давления перекиси этила ее не взрывной распад ускоряется пропорционально давлению только до некоторой критической величины Ркр. Ркр, перекись сразу же после впуска в нагретый реакционный сосуд претерпевает взрывное разложение, сопровождающееся слабой вспышкой голубого цвета. [3]
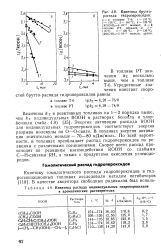 |
Кинетика распада индивидуальных гидропероксидов в ароматических растворителях. [4] |
Энергия активации распада ROOH для индивидуальных гидропероксидов соответствует энергии разрыва молекулы по О-О - связи. В топливах энергия активации значительно меньше - 70 - 80 кДж / моль. По всей вероятности, в топливах преобладает распад гидропероксидов по реакциям с различными соединениями. Скорее всего распад происходит по реакциям взаимодействия ROOH со слабыми С - Н - связями RH, а также с продуктами окисления углеводородов. [5]
Энергия активации распада радикала СН3СО на СН3 и СО, согласно измерениям разных авторов, колеблется между 10 и 20 ккал. Стиси [10], анализируя экспериментальные данные, приходит к заключению, что наиболее вероятным является значение е 18 ккал. [6]
Энергия активации распада этиленгликольдинитрата близка к энергии активации этилнитрата; при добавлении окиси азота начальная скорость газообразования уменьшается ( при 170 С), причем характер ее зависимости от концентрации такой же, как для динитрита. На последующие стадии N0 не влияет. В продуктах распада в присутствии N0 обнаруживается закись азота. [7]
Энергия активации распада комплекса, полученная из наклона зависимостей 2 ( рис. 2) на данном участке, составляет - 3 2 ккал / моль. Для сравнения можно показать, что энергия активации, полученная нами при адсорбции циклопентена на палладиевом катализаторе с тем же носителем, составляет 8 2 ккал / моль и свидетельствует об адсорбции молекул на налладиевых центрах. [8]
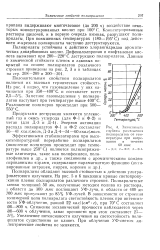 |
Зависимость глубины разложения полиарилатов от температуры при нагревании в течение 60 мин. [9] |
Энергия активации распада полиарилатов Ф-1 и Ф-2 составляет 36 - 41 ккал / моль, Д-3 и Д-4-51-60 ккал / моль. [10]
Энергия активации распада нитрата аммония, согласно работе [275], в твердом состоянии ( 140 - 160 С) составляла 55 ккал / моль, в жидком - 32 ккал / моль. [11]
 |
Кислородсодержащие соединения топлив ( в %. [12] |
Энергия активации распада индивидуальных гидропероксидов 125 - 170 кДж / моль, что соответствовало энергии разрыва О-О - связи. [13]
Энергия активации распада промежуточного аддукта, по данным работы [56], составляет 15 ккал / моль. [15]
Страницы: 1 2 3 4