Энтальпии - вещество
Cтраница 1
Энтальпии веществ, не указанные в табл. 6.3, в частности исходных горючих веществ, вычисляют аналогично от того же нуля. Для расчета абсолютной энтальпии удобно пользоваться стандартной теплотой образования соединения из простых веществ либо теплотой сгорания. [1]
Изменение энтальпии веществ, находящихся в реакторе, повышает или понижает его температуру. Изменение температуры АГ регистрируют подходящим прибором. Умножив AT на среднюю теплоемкость калориметрической системы Ск, получают искомую величину АЯ. [2]
Изменение энтальпии вещества при затвердевании или плавлении обычно называют теплотой плавления. Теплота плавления зависит от кристаллической структуры вещества в твердой фазе. Для определения теплоты плавления ДЯт может быть использовано уравнение Клапейрона, однако в этом случае необходимо иметь данные о зависимости температуры плавления Тт от давления, которые редко имеются в распоряжении исследователя. [3]
Почему необходимо сравнивать энтальпии вещества при стандартных условиях. [4]
С изменением температуры изменяются энтальпии веществ, участвующих в реакции, а поэтому изменяется и тепловой эффект реакции. [5]
В качестве начальной точки отсчета энтальпии вещества в химической практике принята энтальпия простых веществ, считающаяся одинаковой для всех элементарных веществ, находящихся при нормальных условиях в устойчивых агрегатных состояниях. [6]
 |
Шаровой адиабатный калориметр для определения теплоемкости cv. [7] |
Метод адиабатного дросселирования основан на постоянстве энтальпии вещества в процессе дросселирования [ i ( p, ti) t ( p2, t - i) ] и определении энтальпии дросселируемого газа высокого давления по величине энтальпии газа низкого давления, которая находится методом ка-лориметрирования. [8]
 |
Шаровой адиабатный калориметр для определения теплоемкости с. [9] |
Метод адиабатного дросселирования основан на постоянстве энтальпии вещества в процессе дросселирования [ i ( pi, ti) i ( pi, t3) ] и определении энтальпии дросселируемого газа высокого давления по величине энтальпии газа низкого давления, которая находится методом ка-лориметрирования. [10]
Во многих случаях при определении теплоемкости или энтальпии вещества подвод теплоты осуществляется при помощи электрического нагревателя, питающегося от сети постоянного тока. [11]
Уравнение (6.16) является расчетным уравнением при определении изменения энтальпии вещества в проточном калориметре. [12]
Такие вычисления очень просты: изменение энтальпии равно разности энтальпии вещества в конечных состояниях, так как нулевая энтальпия, являющаяся постоянной интегрирования, при этом сокращается. [13]
Общая энтальпия веществ, выходящих из секции, равна общей энтальпии веществ, поступивших в секцию. [14]
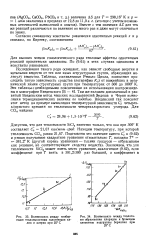 |
Взаимосвязь между изобарными теплоемкостями галогеиидов калия и натрия при 25 С.| Взаимосвязь между теплота-ми образования хлоридов и бромидов, элементов подгруппы бериллия при 25 С. [15] |
Страницы: 1 2 3 4