Равновесный выход
Cтраница 1
Равновесный выход л р обычно вычисляют, используя таблицы значений констант равновесия К, которые имеются в специальных руководствах. С другой стороны, значения К, приведенные в таблицах, вычислены по тем же формулам через равновесный выход продукта, который определили экспериментально. Вид формулы для вычисления константы через равновесный выход продукта хр определяется типом реакции. [1]
Равновесный выход как полезных, так и побочных соединений увеличивается с ростом давления и снижением температуры. [2]
Равновесный выход и скорость образования карбамата аммония по реакции ( а) повышаются с увеличением давления. При температуре около 150 С и давлении 100 ат реакция ( а) идет с высокой скоростью. Равновесие реакции ( б) сдвигается в сторону образования карбамида с повышением температуры. Предел повышения температуры диктуется главным образом усилением коррозии аппаратуры. [3]
Равновесный выход хр обычно вычисляют, используя таблицы значений констант равновесия К, которые имеются в специальных руководствах. [4]
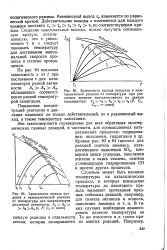 |
Зависимость выхода продукта х экзотермической реакции от температуры для катализаторов различной активности. Ах А2 А3 А4 ( t, Р, Ci - const. [5] |
Равновесный выход хр изменяется по равно; весной кривой. Действительные выходы х изменяются для каждого времени контакта г1 т2 т3 т4 т5 по соответствующим кривым. [6]
Равновесный выход восстановителей зависит от давления процесса, температуры и состава исходной смеси. [7]
Равновесный выход азобутана при 177 С равен 61 вес. [8]
Равновесный выход спирта зависит от условий гидратации - от соотношения Н2О: СаН4, температуры и давления. Поэтому реакцию следует проводить при низких температурах, высоких давлениях и большом мольном соотношении воды и этилена. [9]
Равновесный выход тиофана увеличивается с повышением давления и уменьшением температуры. [10]
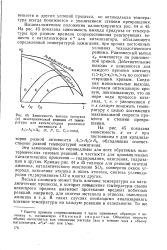 |
Зависимость выхода продукта ( х экзотермической реакции от температуры для катализаторов различной. [11] |
Равновесный выход Хр изменяется по равновесной кривой. Действительные выходы х изменяются для каждого времени контакта Т1т2т3т4Г5 по соответствующим кривым. [12]
Равновесный выход трехокиси серы зависит от состава исходной газовой смеси, температуры и давления. С понижением температуры и повышением давления равновесие реакции смещается в правую сторону. [13]
Равновесный выход двуокиси хлора достигается при температурах, близких к 35 С. Следовательно, чтобы уменьшить образование двуокиси хлора в газовой фазе, процесс обесхлоривания необходимо проводить при температуре, отличающейся от 35 С. [14]
Равновесный выход серного ангидрида при атмосферном давлении для газовой смеси обычного состава [ 7 % ( объемн. [15]
Страницы: 1 2 3 4