Горение - метан
Cтраница 2
Процесс горения метана делится на две стадии: 1) быстрое горение во фронте пламени, при котором практически расходуется весь кислород; 2) относительно медленное изменение состава газовой смеси ( Н2О, СО2, СО, Н2, С2Н3 и СН4), протекающее в отсутствии свободного кислорода. Основное количество ацетилена образуется в первой стадии, но образование его продолжается и во второй. Отличительной особенностью процесса термоокислительного пиролиза метана является то, что он сопровождается горением и является огневым процессом. При этом тепло, необходимое для реакции расщепления метана, получается при сжигании части углеводородных газов, поступающих в зону реакции. [16]
Температура горения метана достигает 2065 С, а давление - до 0 72 МПа. Возникающая при взрыве ударная или взрывная волна может вызвать детонацию. [17]
Процесс горения метана состоит из параллельных и последовательных стадий окисления и термического распада. Поэтому экспериментальное и теоретическое исследование процесса в целом представляет значительную трудность. [18]
Теплота горения метана СН4 по Томсену равна 210000 - 212000 кал. Из элементов, исходя от углеродов в состоянии обыкновенного ( угля, этилен ( СгН4 при сгорании выделяет 230.800 кал) по Фаиру и Зишьберману и Томсену); следовательно, теплота его образования равна 4300, то есть образуется с поглощением теплоты. Частица ацетилена, то есть 26 г, при сгорании выделяет 310.000 кал. Сумма образования СО2 и Н2О равна 261.000; следовательно, и это тело образуется с поглощением 49.000 кал. [19]
При горении метана, как и при горении углерода твс-рдого топлива, подтверждается закономерность образования промежуточного соединения. Таким промежуточным соединением является формальдегид. Антонова и др., 1955 ], применяя в своей работе кинетический метод меченых атомов, убедительно показали, что при горении метана сначала происходит накопление Н2СО, а после достижения некоторого максимума начинает образовываться СО из формальдегида. Таким образом было доказано существование стадии СН20 - СО и показано, что СО является первичным окислом углерода при горении метана. В процессе горения метана возникают радикалы СН3 или СН2, которые приводят к образованию формальдегида. [20]
При горении метана в кислороде выход озона увеличивается с увеличением количества избыточного кислорода, хотя выход перекиси водорода и формальдегида тцэи этом уменьшается. Если кислород горит в метане, то выход перекиси водорода и здесь уменьшается, но выход формальдегида растет с увеличением количества избыточного метана. При этом совершенно не образуется озона. Механизм образования этих продуктов предполагает разложение метана на метилен ( СН2) и атомный водород. Атомный водород образует главным образом молекулярный водород и некоторое количество перекиси водорода. Метилен частью сгорает в окись углерода и формальдегид. Дальнейшее окисление этих продуктов дает воду и двуокись углерода. [21]
При горении метана, как и при горении углерода твердого топлива, подтверждается закономерность об образовании промежуточного соединения. Таким промежуточным соединением является формальдегид. Антонова, Кузьмин, Мошкина, Налбандян, Нейман, Феклисов [8], применяя в своей работе кинетический метод меченых атомов, убедительно показали, что при горении метана сначала происходит накопление Н2СО, а после достижения некоторого максимума начинает образовываться окись углерода из формальдегида, таким образом было доказано существование стадии окисления формальдегида до окиси углерода и показано, что СО является первичным окислом углерода при горении метана. Лавров и Петренко показали, что процесс конверсии метана углекислотой [10] и водяными парами [11] также проходит через образование и разрушение формальдегида. В процессе горения метана возникают радикалы СН3 или СН2, которые приводят к образованию формальдегида. [22]
Исследования процессов горения метана позволили установить, что образование бенз ( а) пирена может протекать в тех местах топки, где значения коэффициента избытка воздуха ( общее или локальные) меньше 1 и где возможно образование сажи. [23]
По исследованию горения метана, являющегося наиболее представительным из углеводородов, имеется значительное количество работ. [24]
Истинную температуру горения метана находим из пропорции: при изменении температуры продуктов горения на 100 теплосодержание их изменяется на 222 3 - 208 1714 13 ккал, а при изменении на Х - ыа 210 8 - 208 172 63 ккал. [25]
Глубокое изучение горения метана в диффузионном пламени показало, что задача создания метановой горелки, близкой по характеристикам к диффузионной струйной горелке Брея для светильного газа, по-видимому, неразрешима. В качестве оснований для такого вывода было указано на то, что оба газа сильно отличаются друг от друга по характеристикам горения и что при сжигании светильного газа скорость воздушного потока у начала пламени значительно выше, чем при сжигании метана, а это способствует лучшему смешиванию газа с воздухом и тем самым повышает устойчивость пламени более быстро-горящего топлива. [26]
Для реакции горения метана необходим не только нагрев до предельной температуры, но и определенное время для саморазгона предпламенной реакции. [27]
В приведенной схеме горения метана реакция 1 получения радикала метила ( СН3) из атомарного водорода ( Н -) является реакцией зарождения цепи. Реакции получения радикала гидропероксида метила ( 2), гидропероксида метила и радикала метила ( 3), метилового спирта и радикала метила ( 5), воды и радикала метила ( 6), радикала НО2 ( 7), метальдеги-да, радикала гидроксила и воды ( 8) являются реакциями развития цепи. [28]
Вычислить теоретическую температуру горения метана с 150 % - ным избытком воздуха, если температура метана и воздуха равна 0; принять Д / / 273 A / / 29S и воспользоваться средними теплоемкостями ( см. Приложение VI, стр. [29]
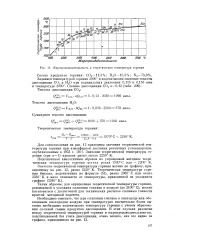 |
Жароироизводительность и теоретическая температура горения. [30] |
Страницы: 1 2 3 4