Константа - скорость - реакция - радикал
Cтраница 2
Здесь ( Ма) и ( Мин) - концентрации алкана и инициирующей добавки; & ин - константа скорости распада инициатора; а и б - некоторые параметры, выражаемые через константы скорости реакций радикалов с молекулами алкана, инициатора, с продуктами распада, со стенками реактора, а также изомеризации радикалов, которые зависят от начальной концентрации алкана. При выводе уравнения ( 36) предполагается, что квадратичным обрывом цепей или рекомбинацией радикалов можно пренебречь. [16]
А и S - концентрации мономера и растворителя; kp, kaa, kar, krr представляют собой соответственно константы скоростей реакций роста цепи, реакции обрыва цепи при взаимодействии полимерных радикалов между собой, полимерного радикала с радикалом, образованным из растворителя, и радикалов, образованных из растворителя, между собой; с - отношение константы скорости реакции, передачи цепи через растворитель к константе скорости реакции радикала растворителя с мономером. [17]
Соотношение скоростей разложения различных углеводородов в смеси равно соотношению констант скоростей реакций радикалов, ведущих цепь, с данными углеводородами. Соотношение констант скоростей реакций данного радикала с различными углеводородами определяется главным образом значениями энергии активации, так как значения предэкспоненциальных множителей близки. Цепи в газофазных термических реакциях развиваются устойчивыми относительно распада активными радикалами СН3, С2Нб, - CeHs и атомами водорода. Реакции этих радикалов с различными углеводородами, которые могут находиться в нефтяных смесях, отличаются энергиями активации ( для различных углеводородов) в пределах 21 кДж / моль ( 5 ккал / моль), что для обычных при пиролизе температур соответствует различию в константах скоростей на один порядок. [18]
Альдегид расходуется только по реакции с надбензойными радикалами. Относительные значения констант скоростей реакций радикалов ROJ с альдегидами, приведенные в табл. 28, показывают, что заместители, увеличивающие электронную плотность в кольце, ускоряют, а заместители, понижающие ее, замедляют реакцию. [19]
NH, но приводит к снижению предэкспоненциального множителя, вследствие экранирующего действия фенильной группы. В силу этого константы скорости реакции радикала ( I) с анилином и ДФА разнятся на два порядка. [20]
Приведенные результаты легко обобщаются на случай, когда радикалы могут реагировать с акцепторами. Пусть К обозначает квазимономолекулярную константу скорости реакции радикала с акцепторами. [21]
 |
Зависимость логарифма константы скорости реакции от объема заместителей. [22] |
В качестве стерических характеристик заместителей были выбраны их эффективные ван-дер-ваальсовы радиусы. Представленная на рис. 1.3 зависимость между константами скорости реакций ку-милпероксидных радикалов с соединениями C6HsCH2 - X и радиусом заместителя X показывает, что при переходе от метиль-ного к грег-бутильному заместителю величины констант скоростей заметно уменьшаются, несмотря на то, что при этом элект-ронно-донорные свойства заместителя увеличиваются, что обыч-но приводит к увеличению реакционной способности. [23]
Одной из главных особенностей теории является Эффект конкуренции, вызванный присутствием в растворе двух или более веществ, способных реагировать с одним и тем же радикалом. Пусть в растворе присутствуют два вещества А и В в концентрациях [ А ] и [ В ], и эти вещества способны реагировать с радикалами R, которые образуются с выходом GR. Константы скорости реакций радикалов с веществами А и В равны & А и & Б, соответственно. [24]
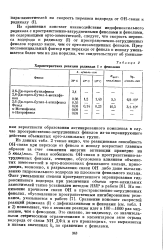 |
Характеристика реакции радикала I с фенолами. [25] |
Из данных табл. 2 также видно, что реакционная способность ОН-связи при переходе от фенола к ионолу возрастает главным образом за счет снижения энергии активации примерно на 5 ккал / молъ. Такая особенность ОН-связи в пространственно-затрудненных фенолах, очевидно, обусловлена влиянием объемистых заместителей в орто-положениях фенильного кольца, приводящих, возможно, к разрыхлению связи ОН либо даже выталкиванию гидроксильного водорода из плоскости фенильного кольца. Сравнение констант скоростей реакций радикала ( I) с дифениламинами и фенолами ( см. табл. 1 и 2) показывает, что с аминами реакция идет в 100 - 1000 раз медленнее, чем с фенолами. Это связано, по-видимому, со значительными стерическими ограничениями в элементарном акте отрыва водорода от связи NH ДФА и его производных, что выражается в низких значениях ka по сравнению с фенолами. [26]
Показана возможность общего подхода к ингибиторам с различными механизмами торможения. На основе этого дана количественная трактовка понятий силы и эффективности тормозящего действия ингибиторов. Сила тормозящего действия ингибитора определяется отношением констант скоростей реакций радикала, образующегося из ингибитора, и радикала, ведущего окисление с углеводородом. [27]
Помимо водородных связей на радикальные жидкофазные реакции влияет ароматичность среды. Образование я-комплексов изменяет реакционную способность частиц. Так, было показано [72], что константы скорости реакции дифенилазотокисного радикала с 2 6-ди-трег - бутил-фенолом намного меньше в бензоле и этилбензоле, чем в гептане, а энергии активации и предэкспоненциальные множители больше в ароматических растворителях. [28]
Как было показано выше, исследование этой конкуренции позволяет сравнивать реакционную способность радикалов относительно взаимодействия их друг с другом и с растворенными веществами. Получающиеся при этом константы, как правило, представляют собой отношение константы скорости реакции радикала с растворенным веществом к константе скорости рекомбинации одинаковых радикалов в степени 1 / 2 или отношение произведения констант скорости реакций двух растворенных веществ с разными радикалами к константе скорости рекомбинации разных радикалов. [29]
Как показывают диффузионно-кинетические расчеты, при N0 12, константах скорости рекомбинации радикалов и реакции с растворенным веществом, равных 10 11 см3 у сек частица ( 6 - Ю9 л / моль - сек), концентрации растворенного вещества 10 - 3 М и коэффициенте диффузии радикалов 4 - Ю 5 см. / сек значения времени i, для которого N ( t) / N0 0 1 ои радиуса r1 / 2 ( t) составляют, соответственно, 2 8 - КГ7 сек. Однако величина /, при которой влияние мощности дозы на выход становится заметным, сильно зависит от выбранного значения константы ск о-рости реакции радикалов с растворенным веществом. Таким образом, значение 7, при котором начинает проявляться зависимость выхода от мощности дозы, - весьма чувствительная функция константы скорости реакции радикалов с растворенным веществом. [30]
Страницы: 1 2 3