Эффективная константа - устойчивость
Cтраница 1
Эффективные константы устойчивости применяются и для характеристики комплексов с красителями: KMF Кдо. [1]
Эффективная константа устойчивости хелатного комплекса Ке определяет вид кривой титрования и отражает зависимость устойчивости комплекса от рН и от присутствия других комп-лексообразующих реагентов. Уравнение ( 184) показывает, что-в общем случае КеК и только в сильнощелочной среде и в отсутствие других реагентов Р 1, и тем самым Ке К. Коэффициенты и и р взаимозависимы. Например, при титровании часто добавляют соль аммония во избежание выпадения осадков:, гидроксидов металлов. Поэтому приходится идти на компромисс. Отсюда ясно, что для эффективного хелатометрического титрования необходимо постоянство условий титрования. [2]
Если металлы образуют комплексы, эффективные константы устойчивости которых достаточно сильно отличаются друг от друга, то при внесении комплексообразующего вещества эти металлы последовательно связываются в комплексы, и исследователю остается лишь фиксировать точки, в которых заканчивается комплексообра-зование каждого из этих металлов. Наблюдение изменения окрасок индикаторов невооруженным глазом при этом оказывается неэффективным, так как окраска одного индикатора мешает распознаванию изменения окраски другого. Поэтому целесообразно применять инструментальные методы индикации конечных точек титрования. С двумя поляризованными электродами можно проводить ступенчатое титрование смеси меди и цинка тетраэти-ленпентамином, которое используют при анализе сыворотки. По-тенциометрическую индикацию точки эквивалентности применяют при последовательном титровании цинка и кадмия [ 58 ( 60) ] и свинца, меди, никеля и кобальта [ 58 ( 56) ] в присутствии щелочноземельных металлов. [3]
При рН раствора 3 5 значение эффективной константы устойчивости быстро уменьшается, так как н растет, а при рН 6 уменьшение / Ceff обусловливается образованием метавана-дат-ионов. Реакции вытеснения и взаимодействия с индикатором иногда протекают медленно, поэтому точка эквивалентности может получаться размытой. [4]
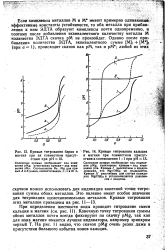 |
Кривые титрования бария и магния при их совместном присутствии при рН 10. [5] |
Если комплексы металлов М и М, имеют примерно одинаковые эффективные константы устойчивости, то оба металла при прибавлений к ним ЭДТА образуют комплексы почти одновременно, и поэтому после добавления эквивалентного количеству металла М количества ЭДТА скачка рМ не произойдет. [6]
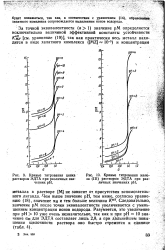 |
Кривые титрования цинка ДТА при чениях р.| Кривые титрования железа ( III раствором ЭДТА при различных значениях рН. [7] |
За точкой эквивалентности ( а1) значение рМ определяется исключительно величиной эффективной константы устойчивости К. [8]
Аналогичным образом, если известны константы устойчивости тартратных и цитратных комплексов [ 57 ( 148) ], можно по уравнению ( 23) вычислить коэффициенты распределения ртартр и Рцитр и определить эффективную константу устойчивости комплексоната MZv - в присутствии тартрат - и цитрат-ионов. Иногда следует принимать во внимание также наличие ацетатных комплексов, если, например, титрование проводят в ацетатном буферном растворе. [9]
Так как концентрация титруемых металлов в большинстве случаев составляет 10 - 4 - 10 - 2 М ( в среднем [ M ] t 10 - 3), ясно, что величина эффективной константы устойчивости образовавшегося хелатного комплекса должна быть равна по меньшей мере 107, если ошибка титрования не должна превышать 1 %, При титровании магния раствором ЭДТА эти условия хорошо соблюдаются при рН 10, тогда как титрование бария уже представляет собой предельный случай. При индикации точки эквивалентности с помощью инструментальных методов значение рМэ можно определить с большей точностью, следовательно, АрМ и ошибка титрования оказываются меньше. Однако при комплексо-нометрических титрованиях скачок рМ в конечной точке часто бывает настолько большим, что и визуальный метод дает очень точные результаты. В этом случае нет необходимости определять рМэ с большой точностью; более того, индикатор в точке эквивалентности резко переходит из одной формы в другую, окрашенную иначе. [10]
Если принять во внимание, что во избежание осаждения приходится работать при относительно низких значениях рН, причем необходимо считаться с высоким значением Igan, то не удивительно, что при полученных таким образом низких значениях эффективных констант устойчивости титрование уранила наталкивается на трудности. [11]
Константы образования некоторых комплексов с ЭДТА все-таки достаточно отличаются друг от друга, для того чтобы можно было селективно титровать соответствующие металлы в присутствии других. Для этого, как уже упоминалось в разделе 4 главы VIII, необходимо, чтобы эффективные константы устойчивости различались по крайней мере в 104 - 105 раз. При взгляде на табл. 2 видно, что алюминий, лантаноиды, а также двухвалентные катионы кобальта, никеля, меди, цинка и кадмия можно титровать в присутствии катионов щелочноземельных металлов, a Fe3 -, Ga3 -, In3 -, T13 -, Bi3 -, Zr4 -, ТЬ4 - ионы, образующие комплексы с константами устойчивости выше 1020, - в присутствии почти всех двухвалентных металлов, что подтверждается практикой. При практическом проведении титрования уменьшают, по мере надобности, рН раствора настолько, чтобы металлы, которые не нужно титровать, практически совсем не связывались в комплекс, так как при - увеличении н эффективные константы устойчивости их комплексов сильно уменьшаются. Титрование алюминия и двухвалентных катионов тяжелых металлов в присутствии щелочноземельных металлов проводят при рН раствора около 5, селективное титрование других трехвалентных катионов в присутствии двухвалентных - при рН3 и ниже. [12]
В ней было показано, что сложные химические равновесия, с которыми мы постоянно сталкиваемся при комплексонометрических титрованиях, можно рассмотреть теоретически с помощью простых математических методов, если ввести понятие об эффективных константах устойчивости ( ранее называвшихся кажущимися константами) хелатных комплексов, вычислить которые можно с помощью коэффициентов распределения. [13]
Константы устойчивости комплексов кадмия и цинка с диаминоэтил-гликольэфиртетрауксусной кислотой ( ДГТА) различаются на 3 9 единицы в логарифмическом масштабе ( lg / ( cd-flr TA16 7: lg / Czn - flrTA12 8), в то время как константы устойчивости комплексов этих металлов с ЭДТА близки. Эта разница может быть еще увеличена, если титрование проводить в аммиачном буферном растворе, так как аммиакат цинка более устойчив по сравнению с комплексом кадмия. В этом случае эффективные константы устойчивости в логарифмическом масштабе различаются на 4 7 единицы. [14]
При этом рН значение ан для ЭДТА уже столь высоко, что эффективная константа устойчивости комплекса A1Y - равна лишь 106 7 и скачок рМ в точке эквивалентности титрования уже невелик. Фактически же при рН 3 еще возможно прямое, титрование А1, и получаются неожиданно хорошие результаты. При немного более низких значениях рН алюминий уже не поддается титрованию. Следует указать на то, что если величина эффективной константы устойчивости комплексоната алюминия составляет 10е 7, то трудно понять, почему титрование железа раствором ЭДТА при рН 2 уже в присутствии умеренных количеств А1 дает отчетливо завышенные результаты. Такое несоответствие между теорией и практикой нуждается в объяснении. [15]
Страницы: 1 2