Стандартная константа - скорость
Cтраница 1
Стандартная константа скорости km характеризует скорости как прямой, так и обратной реакций. В отличие от значений km и k - m ее значение не зависит от выбора электрода сравнения, а в отличие от тока обмена не зависит от концентраций компонентов. Таким образом, эта константа однозначно характеризует кинетические свойства данной электродной реакции. [1]
Для определения стандартной константы скорости электродного процесса по этому уравнению необходимо знать стандартный потенциал. [2]
Для расчета стандартной константы скорости электрохимической стадии ka суммарной электродной реакции (V.12) надо знать константы равновесия обратимых химических стадий [ см. уравнение (V.15) ], сведения о которых особенно трудно получить при небольших степенях заполнения поверхности электрода специфически адсорбированными электрохимически активными комплексами. [3]
Определим также наблюдаемую стандартную константу скорости k аналогично тому, как был введен наблюдаемый ток об мена в уравнении ( 12), а именно путем включения в выражение для k множителя, содержащего фг. [4]
Кинетику систем со стандартными константами скорости в интервале от 10 - 3 до 10 1 см / с можно исследовать методами переменнотоковой полярографии, но эти исследования обычно связаны с достаточно сложными расчетами. [5]
В табл. 3.2 приведены значения стандартных констант скорости для некоторых электродных процессов. [6]
В этом уравнении ks обозначает стандартную константу скорости, EI - потенциал электрода при t 0, а V - скорость развертки напряжения поляризации. [7]
Кг - константа скорости реакции термоокисления гудрона; К0 - стандартная константа скорости термоокислитель-ной реакции гипотетического гудрона, в котором отсутствуют асфальтены; р - реакционная константа термоокислительных превращений смол; а ( [ А ] о) - параметр, отражающий влияние природы i - ro гудрона. [8]
Уравнение дает связь между плотностью тока обмена при рав-гавесном потенциале и стандартной константой скорости реакции. [9]
Из этого критерия следует, что НИП практически нельзя использовать для определения стандартных констант скорости электрохимических реакций, больше чем 0 0& см / с при D0x Ю-5 см2 / с и t3 20 мс. [10]
Аналогично рассчитывают коэффициенты переноса из выражения, связывающего плотность тока обмена со стандартной константой скорости. [11]
Ераая то cRed cOx и ka k k, причем величина fe называется стандартной константой скорости. [12]
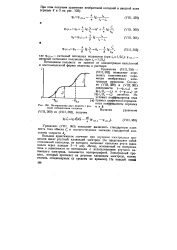 |
Полярограмма двух веществ с раз - а И Р. [13] |
Уравнение ( VIII, 363) позволяет вычислить стандартную плотность тока обмена и соответствующее значение стандартной константы скорости / гя. [14]
Данные этой таблицы в сочетании с уравнением (17.14) связывают разность потенциалов анодного и катодного пиков со стандартной константой скорости реакции и скоростью развертки напряжения поляризации. Это позволяет подобрать экспериментальные условия ( в основном V) таким образом, чтобы разность ( Ера - Epk) n вела к значениям г), которые приведены в табл. 17.2. Теоретически это создает возможность исследования кинетики электродных процессов очень быстрых реакций. При этом следует применять очень большие скорости развертки, для того чтобы были заметны отклонения от обратимости. Это связано со значительными фарадеевскими токами; в таких условиях омическое падение напряжения iR может вызывать существенные ошибки даже при относительно небольшом сопротивлении. Поэтому необходимо сводить к минимуму омическое падение напряжения путем использования, например, капилляра Луггина или высоких концентраций основного электролита. [15]
Страницы: 1 2 3