Стандартная константа - скорость
Cтраница 2
Если электродная реакция включает обратимые химические стадии вида (V.2) и (V.3), то, в соответствии с уравнением (V.15) размерность стандартной константы скорости электродной реакции krs будет зависеть от размерности констант равновесия химических стадий. [16]
Корыта нашел, что для реакции разряда иона цинка на амальгаме цинка в растворах 0 1 - 1 0 М нитрата калия величины кажущейся стандартной константы скорости k, определенные экспериментально и рассчитанные на основании теории Гун - Чапмана, находятся в достаточно хорошем согласии. Арамата и Делахей [18] нашли хорошее согласие с поправкой Фрумкина, исследуя разряд иона цинка из растворов, которые содержали перхлораты магния или бария ( см. табл. 11), однако в растворах перхлоратов натрия и аммония были обнаружены существенные отклонения от теории. Авторы приписывают эти отклонения различию в радиусах ионов цинка и катионов индифферентного электролита ( разд. [17]
Баркер [29] и Мацуда [362] вывели уравнения для замедленных кинетики и массопереноса и связали высоту пика и его форму с коэффициентом переноса и стандартной константой скорости. Для необратимых волн высота пика гораздо меньше, чем для обратимых, причем основное уменьшение приходится на интервал констант скоростей ( k) 1Q4 см-с-1. Для ( k) 10 4 см-с-1 пиковый ток почти не зависит от ( AQ) o, и его значение составляет около 1 / 20 обратимой величины. [18]
Кроме обнаружения промежуточных частиц в ходе окисления или восстановления, циклическая вольтамперометрия позволяет определить такие параметры, характеризующие электродный процесс, как коэффициент переноса а, коэффициент диффузии вещества к электроду D, число электронов, участвующих в электродной реакции, стандартную константу скорости переноса заряда jFs, и, кроме того, установить характер отдельных электрохимических стадий, осложненных химическими реакциями, константы их скорости, порядок реакций. Соотношения для расчета этих параметров в большинстве случаев выведены без учета адсорбции частиц деполяризатора на электродной поверхности или в предположении, что вклад адсорбции незначителен. Для неводных органических растворителей, в которых чаще всего и изучают образование промежуточных частиц, такие случаи могут встречаться сравнительно часто. [19]
Парри и Андерсон [119] ошибочно предположили, что в уравнении ( 48) & Ст относится к катодному процессу, а потенциал полуволны на НИП необратимого окисления выражается аналогичной формулой с заменой коэффициента переноса электронов в катодном процессе на коэффициент переноса в анодном процессе и стандартной константы скорости катодного процесса на стандартную константу скорости анодного процесса. [20]
Парри и Андерсон [119] ошибочно предположили, что в уравнении ( 48) & Ст относится к катодному процессу, а потенциал полуволны на НИП необратимого окисления выражается аналогичной формулой с заменой коэффициента переноса электронов в катодном процессе на коэффициент переноса в анодном процессе и стандартной константы скорости катодного процесса на стандартную константу скорости анодного процесса. [21]
Стандартные константы скорости приведены в табл. 5 наряду с относительными скоростями гидрирования, найденными двумя группами исследователей. [22]
В настоящей работе рассматриваются главным образом возможности некоторых перспективных методов, применимых к исследованию таких полностью необратимых процессов, как восстановление иона водорода на ртути. Хотя стандартные константы скорости таких реакций можно легко получить простыми классическими методами, применение более сложных методов, позволяющих определять большие константы скорости, представляет значительный интерес, так как с их помощью можно изучать необратимые электродные реакции в очень широкой области потенциалов. Можно надеяться, что в будущем такие исследования приведут к более ясному и глубокому пониманию механизмов сложных необратимых электродных реакций. [23]
При этом возникает вопрос, какие критерии следует применять для оценки обратимости процесса. Если известна стандартная константа скорости электродного процесса рассматриваемой системы, то путем вычисления скорости массопереноса и сравнения ее с указанной константой скорости можно сделать заключение об обратимости процесса. [24]
Важное значение имеет зависимость констант скоростей от таких факторов, как потенциал и природа ионов индифферентного электролита. Абсолютные значения стандартных констант скоростей, даже при точном расчете их величин, будут мало способствовать пониманию таких реакций. [25]
Изучен разряд кадмия на амальгамном электроде в присутствии и в отсутствии капроновой кислоты кулоностатическим методом с применением генератрра прямоугольных импульсов и запоминающего осциллографа. Определены величины стандартной константы скорости процесса и коэффициента переноса, а также зависимость между величиной ks и степенью заполнения. [26]
Сравнение этих скоростей массопереноса показывает, что скорость наименее благоприятна в случае дифференциальной импульсной полярографии, но различия между скоростями невелики. Можно принять, что процессы, стандартные константы скорости которых в десять раз меньше скорости массопереноса, практически контролируются скоростью переноса заряда и, следовательно, являются необратимыми. С другой стороны, окислительно-восстановительные системы обратимы, если их стандартные константы скорости более чем в 10 раз превышают скорость массопереноса. [27]
Обычно это потенциал нормального водородного электрода. Несмотря на определение A h, нахождение стандартной константы скорости электродного процесса может оказаться трудным в связи со сложностью точного определения стандартного потенциала. [28]
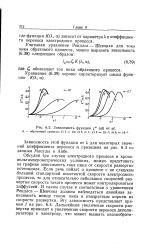 |
Зависимость функции у ( at от at. обратимый процесс. / X 10. 2 К 1. 3 Я. 10 -. 4 К 1Ь. [29] |
Обсудив три случая электродного процесса в хроно-вольтамперометрических условиях, можно представить на графике зависимость тока пика от скорости развертки потенциала. Если речь пойдет о процессе с не слишком большой стандартной константой скорости электродного процесса, то для относительно небольших скоростей развертки скорость такого процесса может контролироваться диффузией. В таком случае в соответствии с уравнением Рендлса - Шевчика должна наблюдаться линейная зависимость между током пика и квадратным корнем из скорости развертки. [30]
Страницы: 1 2 3