Стандартная константа - скорость
Cтраница 3
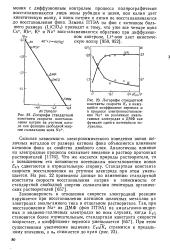
На основании приведенных расчетов можно сделать заключение, что при принятых временах нарушения равновесия системы, характеризующиеся константами скорости меньше 10 - 3 см / с, контролируются только скоростью переноса заряда. Если в таких случаях известен стандартный потенциал, то можно по уравнению (20.66) легко рассчитать стандартную константу скорости, исходя из величины силы тока пика. [31]
Если коэффициенты диффузии частиц О и R приблизительно равны, то результат вычисления ( &0) очень слабо зависит от о. Если для какого-либо изучаемого электролита известна зависимость q от Е, то, как это обычно делается, находят истинную стандартную константу скорости ( k0) и истинный коэффициент переноса. Для констант скоростей реакций первого порядка, не превышающих 10 - 2 см - с-1, особыми преимуществами при кинетических исследованиях обладает полярографический метод ввиду быстроты и легкости его применения. [32]
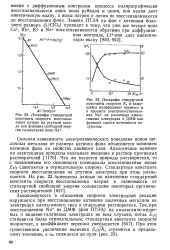
Эта стадия в случае многих органических соединений ( в частности таких, молекулы которых содержат систему сопряженных связей) протекает обратимо и достаточно быстро. Как показывают исследования последних лет с применением различных экспериментальных приемов комплексное использование методов полярографии и фараде-евского импеданса с различными частотами, переменнотоковой полярографии и др.) значения стандартных констант скорости электродных процессов ks при электрохимическом восстановлении органических соединений в диметилформамиде и других апротонных растворителях составляют единицы и десятки сантиметров в секунду. Эти значения действительно малы - порядка ( 0 04 0 02) - г - ( 0 07 0 04) см / с, даже если процесс переноса осложнен химической стадией с участием образующихся анион-радикалов, как, например, в случае катодного восстановления толилэлементофенилацетиленов ( Э 5, Se, Те) в диметилформамиде. Это подтверждает обратимость процесса переноса первого электрона в условиях полярографического исследования. Необходимо отметить, что в последнем примере представляют интерес не только сами значения констант скорости переноса электрона, но и методическая сторона - приведенные значения ks получены для электродных процессов, которые сопровождаются и химической реакцией, и адсорбцией компонентов окислительно-восстановительной системы. Значение ks может служить критерием для оценки механизма электровосстановления веществ, как это показано, например, Глезером и Поспишилом [ 19, с. Важным в выявлении механизма электровосстановления является также вопрос об энергии и энтропии активации реакции переноса заряда, который связан со строением молекул и состоянием их в приэлектродном слое или на поверхности электрода. Речь идет, в первую очередь, о наличии в молекулах восстанавливающихся веществ функциональных групп с элект-ронофильными свойствами либо системы сопряженных связей, благодаря чему облегчается процесс динамической поляризации молекул и, следовательно, появляется возможность передачи электрона от электрода на такие молекулы. [33]
Сильная зависимость электрохимического поведения ионов щелочных металлов от размера катиона фона объясняется влиянием катионов фона на свойства двойного слоя. Что же касается природы растворителя, то с повышением его основности потенциалы восстановления ионов EI / Z сдвигаются в отрицательную сторону. Стандартная константа скорости восстановления на ртутном электроде при этом уменьшается. [35]
Сильная зависимость электрохимического поведения ионов щелочных металлов от размера катиона фона объясняется влиянием катионов фона на свойства двойного слоя. Что же касается природы растворителя, то с повышением его основности потенциалы восстановления ионов Ei / 2 сдвигаются в отрицательную сторону. Стандартная константа скорости восстановления на ртутном электроде при этом уменьшается. [37]
Сравнение этих скоростей массопереноса показывает, что скорость наименее благоприятна в случае дифференциальной импульсной полярографии, но различия между скоростями невелики. Можно принять, что процессы, стандартные константы скорости которых в десять раз меньше скорости массопереноса, практически контролируются скоростью переноса заряда и, следовательно, являются необратимыми. С другой стороны, окислительно-восстановительные системы обратимы, если их стандартные константы скорости более чем в 10 раз превышают скорость массопереноса. [38]
Отсюда следует, что в этих условиях электродные процессы окислительно-восстановительных систем со стандартными константами скорости больше 2 - 1СГ2 см / с практически обратимы и уже недоступны для кинетических исследований. Мы знаем очень много таких систем, поэтому применение классической полярографии весьма ограничено в исследованиях подобного рода. [39]
Страницы: 1 2 3