Кривая - равновесие
Cтраница 1
Кривая равновесия ( рис. 28) строится следующим образом. По оси абсцисс X прямоугольной системы координат в определенном масштабе откладывают содержание х ( в мол. [1]
Кривая равновесия на диаграмме Мак Кеба-Тиле представляет прямую линию. [2]
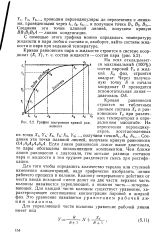 |
График построения кривой равновесия. [3] |
Кривая равновесия строится по табличным данным состава Ха и равновесного Уа при различных температурах в определенном масштабе. [4]
Кривая равновесия ( рис. 7 - 7) точек перегиба не имеет. [5]
Кривая равновесия при постоянной температуре а / ( р) носит название изотермы адсорбции и служит основной характеристикой статики процесса. При относительно высоких парциальных давлениях р содержание адсорбируемого вещества а приближается к постоянной величине ат, характеризующей состояние максимально возможного насыщения адсорбента при данной температуре. [6]
Кривая равновесия дает возможность наглядно проследить за состоянием системы при изменении параметра. [7]
Кривая равновесия может быть рассчитана, если известны коэффициенты активности, или же может быть построена на основе экспериментальных данных. [8]
Кривая равновесия пар-жидкость для системы аммиак-вода и данные для ее построения приведены в книге А. Н. Плановского и Гуревича6 ( стр. [9]
Кривая равновесия между жидким и твердым Не3 была изучена в Аргоннской лаборатории [62] до температуры 0 16 К. [10]
Кривая равновесия характеризует связь между концентрацией жидкости ХБ и соответствующей концентрацией пара у в состоянии равновесия. Кривая равновесия является, следовательно, основой для расчета числа теоретических тарелок графическим методом Мак-Кэба и Тиле [63], который благодаря своей простоте наиболее часто применяется на практике. В табл. П / 4, ряд III ( приложение) приведены кривые равновесия для смесей различного типа. В случае нерастворимых веществ кривая равновесия представляет собой прямую линию ( тип 1), пересекающую диагональ в точке, которая называется особой точкой. В этой точке концентрация паров равна концентрации жидкости; обогащение паров нижекипящим компонентом при более высокой концентрации жидкости хв уже невозможно; наоборот, пары в этой области концентраций жидкости содержат меньше нижекипящего компонента, чем жидкость. [11]
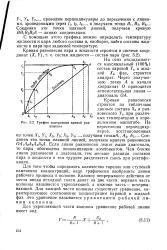 |
График построения кривой равновесия. [12] |
Кривая равновесия строится по табличным данным состава Ха и равновесного Уа при различ - ных температурах в определенном масштабе. [13]
Кривая равновесия заканчивается в точке / С, отвечающей критическому состоянию. Выше этой точки изчезает различие между фазами, области жидких и газообразных состояний не имеют границы. [14]
Кривая равновесия твердое тело - пар начинается также от точки О, по направлению вниз. [15]
Страницы: 1 2 3 4