Кривая - равновесие - смесь
Cтраница 1
Кривая равновесия смеси толуол - н-октан с асимптотическим приближением к диагонали. [1]
Если кривая равновесия смеси, например ж-крезол - п-крезол, незначительно отклоняется от диагонали ( рис. 67), то очень трудно точно построить ступени разделения в интервале низких значений хв и высоких значений ХЕ. В этом случае для облегчения графических построений кривую равновесия следует вычертить в большом масштабе ( порядка 2x2 м), а также дополнительно укрупнить масштаб в интервалах концентраций 0 - 10 % и 90 - 100 % ( мол. При этом кривая равновесия практически принимает вид прямой ( ср. [2]
Ввиду отсутствия опытных данных кривую равновесия смеси метан - этилен - этан - пропан строят по точкам на основании формулы ( 185), стр. [3]
Ввиду отсутствия опытных данных кривую равновесия смеси метан - этилен - этан - пропан строят по точкам на основании фор мулы ( 185), стр. [4]
Преимущество графических методов состоит в том, что они основаны на кривой равновесия смеси, поэтому могут учитывать и неидеальное поведение растворов. Чисто расчетные способы основаны, как правило, на свойствах идеальных растворов. [5]
Согласно уравнению ( 5 - 7а) для более летучего компонента у всегда больше х, поэтому кривая равновесия смеси взаимно растворимых жидкостей располагается над диагональю квадрата, построенного на сторонах л - 100 моль-процентам и г / 100 моль-процентам. Отсюда следует, что для растворов, подчиняющихся закону Рауля, азеотропи-ческой точки не существует. [6]
Кривая равновесия смеси вода-уксусная кислота ( для атмосферного давления) при концентрации уксусной кислоты выше 96 % ( масс.) подходит очень близко к диагонали диаграммы, следовательно, полное удаление воды методом обычной перегонки затруднено. Кроме того, с практической точки зрения недостатком этого способа является ( особенно при высоком содержании воды в исходной смеси) то, что энтальпия испарения для воды почти в пять раз больше, чем для уксусной кислоты. [7]
Проведем аппроксимацию для тех же участков колонны, на которых проводилась аппроксимация кривых равновесия. Пример такой аппроксимации приведен на кривой равновесия смеси ацетона и этиленхлорида при 760 мм рт. ст. ( фиг. [8]
Поясним это на примере. Пусть требуется рассчитать по данным давления паров кривую равновесия смеси бензол - толуол при 760 мм рт. ст., подчиняющейся закону Рауля. [9]
Поясним это на примере. Пусть требуется рассчитать по данным давления паров кривую равновесия смеси бензол - толуол при 760 мм рт. ст., подчиняющейся закону Рауля. [10]
Установлено, что при нейтрализации 1 ж3 маточного раствора выделяется 3 0 м3 углекислого газа и 2 52 кг ацетальдегида. Тепловой эффект нейтрализации соляной кислоты, содержащейся в сточной воде, сухой кальцинированной содой равен 0 05 С. Кривая равновесия смеси ацетальдегид-вода при давлении 760 мм рт. ст. и кривая упругости пара ацетальдегида при различных температурах показывают, что осуществление отгонки ацетальдегида из воды не представляет затруднений. [11]
В общем случае понижение давления сказывается таким образом, что азеотропная смесь обогащается легкокипящим компонентом. Во многих случаях в конце концов при некотором вакууме, азеотропный состав исчезает. Вакуумной перегонкой при 70 мм рт. ст. получают абсолютный спирт и без разделяющего агента. Азеотропная точка на кривой равновесия смеси вода-фенол исчезает при остаточном давлении 32 мм рт. ст. Шнайнкер и Пересслени [ 451 установили, что азеотропная точка смещается следующим образом: азеотроп смеси муравьиная кислота-вода при 55 мм рт. ст. содержит 66 % ( масс.) муравьиной кислоты, а при 200 мм рт. ст. - 72 % ( масс.) кислоты; азеотроп смеси бутанол-бутилацетат при 50 мм рт. ст. содержит 37 % ( мол. [12]
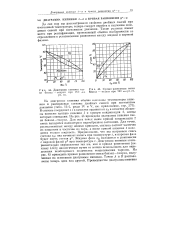 |
Диаграмма кипения смеси бензол - толуол при 760 мм рт. ст. [13] |
На рис. 44 приведена диаграмма кипения смеси бензол - толуол. Для всех точек выше кривой конденсации 2 смесь находится полностью в парообразном состоянии. Для точек, расположенных между обеими кривыми, система состоит частично из жидкости и частично из пара, а ниже кривой кипения 1 находится только жидкость. На рис. 45 приведена кривая равновесия смеси бензол - толуол, полученная на основании диаграммы кипения. Точки А и В расположены теперь одна над другой. [14]
На диаграмме кипения обычно показаны температуры. В системе координат с t в качестве ординаты и хв в качестве абсциссы наносим кривую кипения 1 и кривую конденсации 2, концы которых совпадают. На рис. 44 приведена диаграмма кипения смеси бензол-толуол. Для всех точек выше кривой конденсации 2 смесь находится полностью в парообразном состоянии. Для точек, расположенных между обеими кривыми, система состоит частично из жидкости и частично из пара, а ниже кривой кипения 1 находится только жидкость. Диаграмма кипения экспериментально определяется так же, как и кривая равновесия ( см. главу 4.63); аналогичным путем ее можно использовать для определения необходимого количества теоретических тарелок. На рис. 45 приведена кривая равновесия смеси бензол-толуол, полученная на основании диаграммы кипения. Точки А и В расположены теперь одна над другой. [15]
Страницы: 1