Потенциометрическая кривая
Cтраница 1
Потенциометрические кривые на рис. 3 показывают, что в избытке реакционноспособного золя окиси кремния продукты гидролиза ионов алюминия вступают, главным образом, во взаимодействие с гидроксильными группами золя кремниевой кислоты, а не поли-меризуются друг с другом с образованием рыхлой гидроокиси алюминия. [1]
Потенциометрическая кривая показывает, что в сильнокислой и сильнощелочной областях незначительным изменениям рН соответствуют весьма большие количества нейтрализующего реагента. Следовательно, в этих областях регулирование по рН обеспечивает сравнительно невысокую точность. Регулирование в этой области значений рН без принятия специальных мер неустойчиво. К таким мерам относится прежде всего устройство соответствующих систем регулирования и совершенных дозаторов, позволяющих точно отмерять весьма малые количества реагента. [2]
Потенциометрические кривые лолифункциональных ОН-анио-нитов ЭДЭ-Юп, АН-2ф, АВ-16 ( рис. 19) имеют несколько перегибов в различном интервале рН, что указывает на наличие нескольких активных групп в анионите, имеющих различные степени диссоциации. Как видно из рис. 19, монофункциональный анионит АВ-17 имеет только один перегиб. Следует, однако, учитывать, что при недостаточной чувствительности измерительной аппаратуры и большой полифункциональности ионнта эти перегибы не всегда четко выражены. [3]
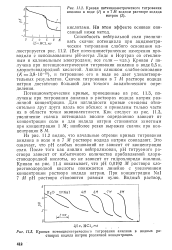 |
Кривая потенциометрического титрования анилина в воде ( / и в 7 М водном растворе иодида.| Кривые потенциометрического титрования анилина в водных растворах иодида натрия различной концентрации. [4] |
Потенциометрические кривые, приведенные на рис. 11.3, получены при титровании анилина в растворах иодида натрия различной концентрации. Для наглядности кривые смещены относительно друг друга вдоль оси абсцисс и приведены только части их в области точки эквивалентности. [5]
Потенциометрические кривые, как и обычные кривые титрования, имеют максимальную крутизну в точке эквивалентности. Если кривая в области перегиба почти вертикальна, то конечная точка определяется с высокой точностью по максимальному относительному ( в расчете на единицу объема титранта) изменению потенциала. [6]
Потенциометрические кривые, как и обычные кривые титрования, имеют максимальную крутизну в точке эквивалентности. Если кривая в области перегиба почти вертикальна, то конечная точка определяется с высокой точностью по максимальному относительному ( в расчете на единицу объема титранта) изменению потенциала. Если кривая имеет пологую форму, например при титровании разбавленных растворов или слабодиссоциированных кислот и оснований, точное определение конечной точки титрования затруднено. [7]
Потенциометрическая кривая, заснятая на электродной паре платина - вольфрам, при малых концентрациях хлора ближе к линей - ной, при больших ( более 5 мг / л Ci2) - к экспоненте. Для измерения Е использовалась аппаратура, предназначенная для измерения величины рН и окислительно-восстановительного потенциала, - арматура датчиков и высокоомные преобразователи П-261 и П-201. [8]
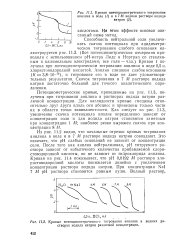 |
Кривая потенциометрического титрования анилина в воде ( / и в 7 М водном растворе иодида.| Кривые потенциометрического титрования анилина в водных растворах иодида натрия различной концентрации. [9] |
Потенциометрические кривые, приведенные на рис. 11.3, получены при титровании анилина в растворах иодида натрия различной концентрации. Для наглядности кривые смещены относительно друг друга вдоль оси абсцисс и приведены только части их в области точки эквивалентности. [10]
Потенциометрические кривые, полученные при титровании этих двух кислот раствором гидроокиси натрия, отличаются из-за большой разницы степеней диссоциации кислот. Соляная кислота, практически полностью диссоциирующая, при потенциометрическом титровании дает большой изгиб в конечной точке титрования, тогда как борная кислота с константой диссоциации, приблизительно равной 10 - 10, в подобных экспериментальных условиях не дает пригодной для определения конечной точки титрования. [11]
Экспериментальные потенциометрические кривые, полученные при использовании золотого и стеклянного электродов при восстановлении хрома в чистом растворе, показаны на рис. XI. Характерной особенностью кривых титрования является большой скачок потенциала, достигающий 250 мВ и более, из положительной области в отрицательную при переходе хрома из шестивалентной формы в трехвалентную. [12]
Получаемые потенциометрические кривые для различных ионитов можно сопоставить и установить по характеру и ходу этих кривых ( рис. 11 - 13) наличие определенных функциональных групп в зернах ионита, степень их диссоциации с изменением рН раствора, полную ионообменную емкость для каждого ионита, что определяется по сумме всех функциональных групп, вступающих постепенно в реакцию, обменную емкость по отдельным функциональным группам и равновесную обменную емкость при постоянном рН раствора. [13]
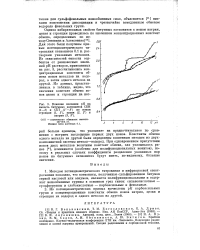 |
Влияние значения рН на емкость битумных катионитов СБН ( 1 - 3 и СБТ. (. - 3 по ионам стронция ( 1, 1, цезия ( 2, 2 и натрия ( 3, 3. [14] |
Из потенциометрических кривых вычислены - рК карбоксильных групп и концентрационные константы обмена ионов натрия, цезия и стронция на водород и одного металла на другой. [15]
Страницы: 1 2 3 4