Анодная катодная поляризационная кривая
Cтраница 1
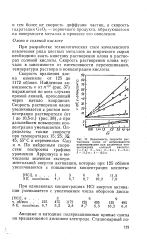 |
Зависимость скорости растворения олова от интенсивности перемешивания при различных концентрациях соляной кислоты. / - 1 - н.. 2 - 3 - н.. 3 - 6 - н.. 4 - 9 - н.. 5 - 11 5 - н.. 6 - 10 5 - н. [1] |
Анодные и катодные поляризационные кривые сняты на вращающемся дисковом электроде. [2]
Поскольку анодные и катодные поляризационные кривые различны и поведение электродов неизвестно, при моделировании устанавливают нелинейные двухполюсники, соответствующие как анодному, так и катодному направлениям тока через каждый электрод. Каждый такой элемент включен последовательно с диодом, в результате чего в схеме автоматически устанавливается ток необходимой величины и направления. [3]
Получены анодные и катодные поляризационные кривые хрома с использованием графитового электрода в насыщенном растворе гидроокиси бария, содержащем хром в трехвалентном состоянии. [4]
Были изучены анодные и катодные поляризационные кривые, последние снимались гальваностатическим методом. [5]
Для этого снимаются анодные и катодные поляризационные кривые. В общем случае анализ формы поляризационных кривых и изучение характера их зависимости от состава раствора, температуры, ингибирующих добавок позволяют получить довольно полные сведения о природе изучаемого электрохимического процесса. В зависимости от того, как влияют на кинетику электрохимической реакции конкретные ингибиторы и в какой степени замедляют ее, их делят на анодные, катодные или смешанные. [6]
На основании рассмотрения анодных и катодных поляризационных кривых, изучения изменений потенциала образцов во времени и определения скорости коррозии металлов в растворах с различными добавками уротропина и без него можно сделать заключение, что уротропин является смешанным замедлителем. [7]
В смеси уксусной и муравьиной кислот анодные и катодные поляризационные кривые каждой из изученных сталей пересекаются в трех точках: активной области, области пассивации и пассивной области. Этим точкам пересечения должны соответствовать и значения стационарных потенциалов, то есть стационарные состояния металла. Для такой системы должны быть стабильны два состояния, соответствующие пересечению поляризационных кривых в активной либо пассивной областях. [8]
Электрохимические исследования коррозионного поведения стали проводили путем снятия анодных и катодных поляризационных кривых в специально разработанной электрохимической прижимной трехэлектродной ячейке, снабженной дополнительно штуцером для продувки инертным газом ( гелием) и гидрозатвором. [9]
В чистой влажной атмосфере без активатора и защитной пленки поляризационная диаграмма может быть представлена серией анодных и катодных поляризационных кривых. [10]
Электрохимические методы коррозионных испытаний основаны на определении скорости коррозии в токовых единицах, получаемых при снятии анодных и катодных поляризационных кривых. Если коррозия протекает по электрохимическому механизму, то, зная уравнение реакции, скорость коррозии, выраженную в единицах плотности тока ( обычно мА / см2) при помощи закона Фарадея можно перевести в массовый показатель скорости коррозии. [11]
Одним из методов изучения коррозионного поведения металлов и сплавов, определения эффективности и механизма действия ингибиторов является получение анодных и катодных поляризационных кривых. [12]
Коррозия двухфазных сплавов с математической точки зрения легче поддается изучению, так как при условии, если катодный деполяризатор или не необходим, или же если и необходим, но подводится в избытке, можно ожидать, что катодные и анодные площади будут независимы от скорости коррозии и определяются отношением площадей двух фаз. В тех случаях, когда анодные и катодные продукты образуют при взаимодействии слаборастворимые вещества, при уменьшении величины составляющих вероятность торможения повышается. В отсутствии такого усложнения скорость коррозии можно вычислить, если известны анодные и катодные поляризационные кривые, методом пересечения этих кривых, а если проводимость жидкости низка, - при помощи выделения отрезка между двумя точками ( фиг. Необходимо заметить, что так как поляризация зависит от плотности тока, а не от абсолютной силы тока, анодные кривые становятся круче с уменьшением количества анодной фазы, и скорость коррозии вообще уменьшается пропорционально количеству разрушаемой фазы. Количественного электрохимического изучения этого случая не было, но надо надеяться, что такое изучение будет проведено. [13]
Возможность практического использования полученного соотношения для определения деформационного изменения тока коррозии обосновывается так же, как и в известном методе снятия реальных поляризационных кривых для определения скорости коррозии металла на основе кинетической теории коррозии: идеальные поляризационные кривые, определяющие стационарный потенциал и ток коррозии, рассматриваются как продолжение тафелевских участков реальных поляризационных кривых. На рис. 66 реальные поляризационные кривые показаны сплошными линиями. Для практического расчета скорости коррозии в формулу ( 245) следует подставлять величины сдвигов потенциалов, определенные сечением реальных анодных и катодных поляризационных кривых для произвольно выбранного значения плотности тока гальваностатической поляризации в пределах тафелевских участков. [14]
Если контактирующие металлы погружены в неаэрируемые растворы, где коррозия сопровождается выделением водорода, увеличение площади более благородного металла приводит к увеличению коррозии менее благородного. Наклон кривой / отвечает поляризации более благородного металла, имеющего высокое водородное перенапряжение. Наклоны кривых 2 и 3 отвечают металлам с низким водородным перенапряжением. Проекции точек пересечения анодных и катодных поляризационных кривых на ось lg / дают соответствующие гальванические токи. Заметим, что любой металл, на котором происходит разряд ионов водорода, является водородным электродом, который при давлении водорода 0 1 МПа имеет равновесный потенциал - 0 059 рН вольт. На оси абсцисс вместо логарифма полного тока нанесен логарифм плотности тока. [15]
Страницы: 1 2