Анодная кривая
Cтраница 1
Анодные кривые 2 и 3 проходят также в области более положительных потенциалов по сравнению с кривой фона. При плотности тока до 100 ма / см наибольшее торможение оказывает нит-ротерефталат натрия, при больших плотностях - нитротерефтадат гекоаметиленишна. Таким образом, установлено что исследованные ингибиторы ускоряют катодный процесс и замедляют анодный. [1]
Анодные кривые также различаются величиной первого критического анодного тока. Величина критического анодного тока пассивации границ значительно больше величины первого критического анодного тока пассивации тела зерна. [2]
 |
Поляризационная диаграмма, характеризующая склонность нержавеющей стали к межкристаллитной коррозии. [3] |
Анодные кривые снимали на закаленной с температуры 1100 С ( выдержка 60 мин) и отпущенной ( 650 С, 4 ч) стали. Путем сравнения этих кривых была определена область потенциалов, при которых в отпущенной стали должно наблюдаться преимущественное растворение границ зерен. Было установлено, что на отпущенной стали преимущественное растворение границ зерен происходит при потенциалах от - 0 2 до 0 2 в. Наиболее интенсивно протекает процесс при потенциалах от - 0 1 до 0 1 в. При более положительных потенциалах даже длительная выдержка не приводит к повышенной травимости границ. На закаленной стали во всем диапазоне потенциалов наблюдается равномерное растворение. [4]
Анодная кривая при 20 похожа на кривую, полученную Зарецким ( см. фиг. [5]
Анодная кривая a i отвечает металлу, большая часть поверхности которого закрыта пленкой. Величина равновесного потенциала на рисунке не отмечена, так как для подобных металлов она весьма отрицательна. Анодная поляризация, освобождая в некоторой степени поверхность металла, приводит к увеличению скорости анодного и катодного процессов. Устанавливается новое значение рс, мало отличающееся от сре ( гл. III, § 8), а скорость анодного и катодного процессов заметно возрастает, что и характерно для отрицательного дифференц-эффекта. Когда образование защитных пленок невозможно ( например, алюминий в растворах щелочей или амальгама алюминия), отрицательный дифференц-эффект не наблюдается. [6]
Анодные кривые для титана и хрома одинаковы. На кривой можно отметить следующие характерные точки: Vcm - стационарный потенциал, внешний ток равен нулю, Vп - потенциал начала пассивации соответствует максимальному току анодного растворения металла. При потенциалах, более положительных, чем потенциал полной пассивации, металл находится в пассивном состоянии, поддерживаемом внешней анодной поляризацией. Различие в анодном поведении титана и хрома состоит в следующем: при высоких положительных потенциалах пассивное состояние титана не нарушается, в то время как у хрома наступает состояние перепассивации [10-12], в котором он начинает растворяться в виде шестивалентных ионов. Потенциал полной пассивации у хрома более отрицательный, чем у титана. Перенапряжение водорода на хроме несколько более низкое, чем на титане. Поэтому в области потенциалов, где титан активно анодно растворяется на молибдене, протекают катодные процессы. Анодное растворение молибдена наблюдается только при значительном смещении его потенциалов в положительную сторону. Сопоставлением весовых потерь и количества пропущенного электричества установлено как в наших опытах, так и в работе [13], что растворение молибдена происходит в виде шестивалентных ионов. Молибден является кор-розионностойким металлом в серной кислоте. [7]
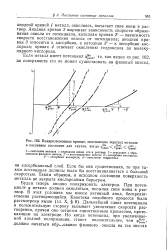 |
Поляризационные кривые, поясняющие переход металла в пассивное состояние для случая, когда ср аевн f s cf H. [8] |
Анодная кривая 2 выражает зависимость скорости образования окисла от потенциала, катодная кривая 2 - зависимость скорости восстановления окисла от потенциала; анодная кривая 3 относится к адсорбции, а катодная 3 - к десорбции кислорода; кривая 4 отвечает окислению гкдроксила до молекулярного кислорода. [9]
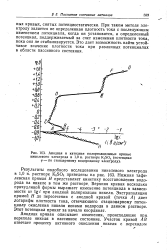 |
Анодная и катодная поляризационные кривые. [10] |
Анодная кривая описывает изменения, происходящие при, переходе никеля в пассивное состояние. [11]
 |
Зависимость скорости коррозии V ( 1 и Мо ( 2 от потенциала в 30 % - ной H2SO4 при 100 С. [12] |
Анодные кривые этих металлов также совпадают до потенциалов 350 - 400 мв. [13]
Анодные кривые вследствие отсутствия поляризации имеют очень пологий вид, что характеризует отсутствие пассивности и протекание коррозионного процесса без заметного торможения. Кривые катодной поляризации во всех случаях имеют относительно большую крутизну, что указывает на возможность прекращения или значительного торможения процесса коррозии образца при катодной поляризации. [14]
Анодная кривая описывает изменения, происходящие при переходе никеля в пассивное состояние. [15]
Страницы: 1 2 3 4 5