Летучесть - галогенид
Cтраница 1
Летучесть галогенидов РЗЭ и, в частности, хлоридов при температурах ниже 1000 С незначительна - этот факт открывает пути отделения РЗЭ от других элементов, хлориды которых обладают более низкими температурами кипения. [1]
 |
Взаимосвязь между стандартными энтальпиями образования высших оксидов элементов IV и V групп. [2] |
Летучесть галогенидов ЭГ растет при увеличении числа л, что обусловливает способность к диспропорционированию низших галогенидов при нагревании. Это объясняет и тот факт, что некоторые высшие галогениды более стойки не а твердом, а газообразном состоянии. [3]
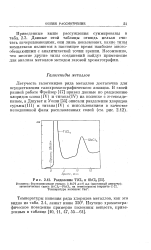 |
Разделение TiCU и 8ЬС13. [4] |
Летучесть галогенидов ряда металлов достаточна для осуществления газохроматографического анализа. [5]
Зависимость плавкости и летучести галогенидов от природы галогена проявляется различно. При наличии ионных структур температуры плавления и кипения по ряду F - С1 - Вг-I обычно понижаются, при наличии молекулярных структур - повышаются. [6]
Зависимость плавкости и летучести галогенидов от природы г а-лоида проявляется различно. При наличии ионных структур температуры плавления и кипения по ряду F - С1 - Вг - I обычно понижаются, при наличии молекулярных структур - повышаются. [7]
Зависимость плавкости и летучести галогенидов от природы галоида проявляется различно. При наличии ионных структур температуры плавления и кипения по ряду F - С1 - Вг - I обычно понижаются, при наличии молекулярных структур - повышаются. [8]
 |
Давление паров галогенидов урана. [9] |
В табл. 5.22 собраны данные по температурам плавления, кипения и летучести галогенидов урана. [10]
Такая обработка не годится - однако, для соединений типа RHgX ( где X - галоген, a R - т - органический радикал) вследствие летучести галогенидов ртути. В этом случае рекомендуется следующий ход анализа. Навеску в 0 2 - 0 3 г пробы помещают в коническую колбу емкостью 300 мл, прибавляют 40 мл ледяной уксусной кислоты, обрабатывают 2 мл брома и дают постоять 20 мин. Вставляют в горло колбы маленькую воронку с обрезанной трубкой, прибавляют 3 мл соляной кислоты и вос-станав / ливают ртуть, прибавляя небольшими порциями цинковую пыль при температуре ниже 50 С. По исчезновении окраски брома прибавляют избыток цинковой пыли и дают раствору стоять 3 ч или, лучше, оставляют его на ночь. Затем прибавляют 0 5 г тонко измельченного силикагеля для удаления коллоидной ртути и декантируют при слабом отсасывании через тигель Гуча, в который предварительно укладывают довольно толстый слой асбеста, покрытый слоем тонко измельченного силикагеля. Осадок несколько раз промывают декантацией и затем переносят обратно в колбу или весь тигель, или же только слой асбеста с находящимся на нем осадком и обмывают тигель над колбой 20 мл разбавленной ( 1: 1) азотной кислоты. По окончании реакции прибавляют 10 мл азотной кислоты, слабо нагревают до растворения всей ртути и приливают концентрированный раствор перманганата до появления розовой окраски, не исчезающей в течение 5 мин. Удаляют избыток перманганата, прибавляя по каплям свежеприготовленный раствор сульфата железа ( II), и далее ведут анализ, как описано на стр. [11]
Галогены являются частыми спутниками гетероэлементов в органических соединениях, и поэтому вопрос об образовании галогенидов гетероэлементов в процессе разложения элементо-органических соединений представляет значительный интерес. Летучесть галогенидов может создать помехи при определении углерода, водорода или галогена и быть причиной потерь гете-роэлемента. В условиях сухого окисления газообразным кислородом разрыв связей гетероэлемент - галоген более характерен, чем их образование. Наличие постоянного избытка одного из реагентов ( кислорода) и непрерывное удаление из сферы реакции газообразных веществ создают благоприятные условия для превращения гетероэлементов в оксиды. Для органических соединений многих гетероэлементов даже при наличии в веществе связи гетероэлемент - галоген последний полностью уходит из зоны разложения в газообразной форме. Это открывает путь к раздельному поглощению углерода, водорода, галогена и гетероэлемента и их одновременному определению. [12]
Во-вторых, как установили Звара и др. [568] в результате изучения летучести галогенидов, элемент 104, курчатовий, является химическим аналогом не предшествующих элементов, а гафния. Таким образом, учитывая, что 5 / - элементов должно быть 14, хотя бы формально родоначальником ЭТОПУ семейства следует считать актиний. Сложность и сильное отличие химии элементов первой половины актиноидного семейства от химии элементов второй половины вполне естественно объясйяется более слабой энергией связи первых 5 / - электронов с ядром. Это обстоятельство обусловливает их легкий переход в валентную зону. [13]
Это установлено в лаборатории микроанализа ИНЭОС АН СССР на примере анализа циклопентадиенилталлия. Как выяснено работами Гельман и Шевелевой [ 86а ], элементарный анализ соединений типа RTlHal2 и RaTlHal затруднен летучестью галогенидов одновалентного таллия. Для того чтобы задержать галогениды таллия в трубке для сожжения, рекомендуется охладить льдом часть трубки длиной 6 - 8 см, находящуюся между зоной сожжения и окислительной зоной. Кроме того, в тех случаях, когда в веществе содержится больше галоида, чем нужно для образования галогенида одновалентного таллия ( для соединений типа, например, RTlHal2), необходимо помещать между окислительной зоной и охлажденной частью трубки нагретое серебро для улавливания галоида. Даже принятие таких мер предосторожности не всегда позволяет избежать уноса галогенидов таллия из трубки для сожжения. Описанным способом были получены удовлетворительные результаты для ряда галоидсодержащих таллийорганических соединений с непредельными и ароматическими радикалами. [14]
Страницы: 1