Напряжение - разложение
Cтраница 1
Напряжение разложения может быть вычислено и теоретически из свободных энергий и теплоемкостей всех компонентов, участвующих в процессе. Нужно подчеркнуть, что экспериментально измеренное напряжение разложения никогда не бывает выше этой теоретической величины. Это объясняют большой скоростью всех процессов при высоких температурах. Наоборот, очень часто измеренное напряжение разложения оказывается значительно ниже теоретического. Иными словами, при электролизе расплавов имеет место деполяризация. Она обусловлена растворением катодно выделенного металла в электролите и обратным взаимодействием продуктов электролиза. [1]
Напряжение разложения является термодинамической характеристикой электрохимической системы и мало зависит от условий электролиза. [2]
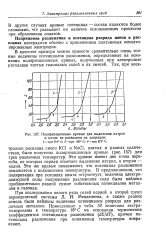 |
Поляризационные кривые для выделения натрия и калия из расплавов их хлоридов. [3] |
Напряжение разложения и потенциал разряда ионов в расплавах измеряются обычно с применением платиновых веплати-нированных электродов. [4]
Напряжение разложения всякого электролита складывается из разности потенциалов между анодом и раствором, называемой анодным потенциалом, и разности потенциалов между раствором и катодом, называемой катодным потенциалом. Анодный и катодный потенциалы называются также потенциалами разряда аниона и катиона. [5]
Напряжение разложения обусловлено природой реагирующего вещества, а поэтому не может быть изменено. [6]
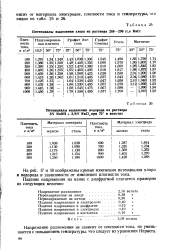 |
Потенциалы выделения хлора из раствора 260 - 290 г / л NaCl. [7] |
Напряжение разложения не зависит от плотности тока, но уменьшается с повышением температуры, что следует из уравнения Нернета. [8]
Напряжение разложения, рассчитанное на основании термохимических данных имеет обычно более высокое значение, чем экспериментально найденные величины. Это указывает на то, что в расплавах существует явление деполяризации за счет взаимодействия катодных и анодных продуктов электролиза между собой и с электролитом. [9]
Напряжение разложения всякого электролита складывается из разности потенциалов между анодом и раствором, называемой анодным потенциалом, и разности потенциалов между катодом и раствором, называемой катодным потенциалом. Анодный и катодный потенциалы называются также потенциалами разряда ( выделения) аниона ии катиона. [10]
Напряжение разложения - это минимальное напряжение, после превышения которого начинается длительный электролиз с выделением продуктов на аноде и катоде. [11]
Напряжение разложения определяется экспериментально путем снятия кривой величина тока - напряжение. Первоначально через ячейку проходит весьма малый остаточный ток, при этом на электродах не наблюдается видимого выделения продуктов электролиза - газообразных водорода и кислорода. Далее, по достижении соответствующей величины напряжения разложения ток в ячейке быстро возрастает и на электродах наблюдается газовыделение. [12]
Напряжение разложения является термодинамической характеристикой электрохимической системы и мало зависит от условий электролиза. [13]
Напряжение разложения МпС12, рассчитанное по термодинамическим данным, составляет 1 74 в; в то время как напряжение поляризации равно 2 22 - 2 26 в, МпС12 с хлоридами щелочных металлов может образовывать комплексные ионы, что может повысить величину потенциала выделения марганца. [14]
 |
Электрическая схема для определения потенциалов разложения по Леблану. [15] |
Страницы: 1 2 3 4