Подгруппа - скандий
Cтраница 2
Соединения металлов подгруппы скандия напоминают по свойствам соединения щелочноземельных металлов, хотя их состав аналогичен соответствующим соединениям алюминия. [16]
Все элементы подгруппы скандия и лантаниды - активные металлы, легко окисляющиеся при умеренных температурах. [17]
Все элементы подгруппы скандия ( относительно прометия еще нет точных данных) получены в виде металлов. [18]
Все элементы подгруппы скандия, в том числе и торий, легко соединяются с галогенами. [19]
Соединения элементов подгруппы скандия применяют в полупрб-водниковой технике. [20]
В природе элементы подгруппы скандия находятся в соединениях. Минералы, богатые каким-либо из рассматриваемых элементов, встречаются редко. Обычно элементы подгруппы скандия можно найти в иттриевых и цериевых землях, в состав которых входят многие элементы побочной подгруппы третьей группы. Названия иттриевые и цериевые земли указывают, что в первых преобладающим элементом является иттрий, а во вторых - церий. Основной минерал в цериевых землях - это монацит, представляющий собой безводный фосфат элементов третьей группы, главным образом церия и лантана ( Се, La) PO4 Монацит и есть важнейшее сырье для получения лантана и его аналогов, а также тория. [21]
Электроположительные свойства металлов подгруппы скандия усиливаются с увеличением атомного номера. В чистом виде скандий, иттрий, лантан и актиний получить сравнительно трудно. Обычно они образуются при электролизе расплавленных галоге-нидов. [22]
Как относятся элементы подгруппы скандия к водороду. [23]
По активности элементы подгруппы скандия уступают лишь щелочным и щелочно-земельным металлам. [24]
Нормальные потенциалы элементов подгруппы скандия ( в кислой среде) равны соответственно - 2 08 ( Sc), - 2 37 ( Y), - 2 52 ( La) в. Иттрий по величине потенциала равен магнию, а лантан даже более металличен. [25]
Для всех элементов подгруппы скандия известны серо-черные гидриды типа ЭНг. Теплоты образования YH2 и LaH2 5 8 -равны соответственно 44 и 50 ккал / моль. [26]
Как относятся металлы подгруппы скандия к водороду. [27]
Все гидроокиси элементов подгруппы скандия типа Э ( ОН) 3 представляют собой основания. Ионы некоторых лантаноидов имеют окраску, поэтому соли таких элементов окрашены в тот или иной цвет. Например, соли неодима имеют фиолетово-розовый цвет, а соли европия - белые с розоватым оттенком. Обычно окись типа Э2О3 и соли того же элемента с трехвалентным катионом имеют одинаковую окраску. Так, окись эрбия Ег2О3 и соли, в которых этот элемент трехвалентен, окрашены в розовый цвет. Для некоторых элементов окраска их окислов и солей неодинакова. Например, окись неодима Nd2O3 - голубая, а соли этого элемента фиолетово-красного цвета. [28]
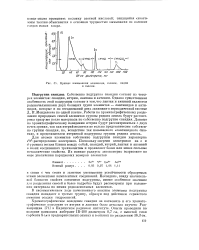 |
Кривые вымывания алюминия, галлия, индия. [29] |
Для атомов элементов собственно подгруппы скандия характерно - распределение электронов. Поскольку энергии электронов на s и rf - уровнях весьма близки между собой, скандий, иттрий, лантан и актиний в своих соединениях трехвалентны и проявляют более или менее сильные металлические свойства. [30]
Страницы: 1 2 3 4