Титриметрический анализ
Cтраница 1
Титриметрический анализ в отношении скорости выполнения дает огромное преимущество по сравнению с гравиметрическим анализом. Ускорение определений достигается благодаря тому, что вместо взвешивания продукта реакции при титриметрическом анализе измеряют объем затрачиваемого на ее проведение раствора реагента, концентрация ( или, как говорят, титр) которого всегда точно известна. Таким образом, в титриметрическом ( объемном) анализе количественное определение химических веществ осуществляется чаще всего путем точного измерения объемов растворов двух веществ, вступающих между собой в реакцию. [1]
Титриметрический анализ второй пробы проводится аналогично тому, как описано выше, но при этом ( если автотитратор работает непрерывно) фиксируется не 240 значений выходного сигнала, а толькоNI ЭКв 30 значений, т.е. фиксируется на 30 точек больше, чем это соответствует конечной точке титрования первой пробы. [2]
Титриметрический анализ имеет ряд преимуществ леред гравиметрическим методом, а именно: скорость выполнения определений, относительную простоту ( несложность) операций, достаточную точность получаемых результатов. [3]
Титриметрический анализ имеет ряд преимуществ перед гравиметрическим методом, а именно: скорость выполнения определений, относительную простоту ( несложность) операции, достаточную точность получаемых результатов. [4]
Титриметрический анализ является методом количественного анализа, в котором измеряют количество реактива, затраченного в ходе химической реакции. В титриметрическом анализе широко используют точное измерение объемов реагирующих веществ. В этом случае при определении, например H2SO4, достаточно знать ее объем и объем и концентрацию щелочи. Реакция между кислотой и щелочью протекает мгновенно, окончание реакции фиксируется точно, поэтому измерения объемов и вычисления можно провести менее, чем за 15 мин. Титриметрические методы дают большой выигрыш во времени, поэтому их так широко используют в химических лабораториях. [5]
 |
Наблюдение за правильностью установки мениска. [6] |
Титриметрический анализ основан на измерении объ-1 емов растворов реагирующих веществ. Тысячная доля литра, составляет миллилитр. [7]
Титриметрический анализ основан на точном измерении объема раствора реагента известной концентрации, израсходованного на реакцию. [8]
Титриметрический анализ основан на точном измерении объемов веществ, вступающих в химическую реакцию. В этом методе используют растворы реактивов точно известной концентрации - титранты. Процесс медленного прибавления титранта к раствору определяемого вещества называется титрованием. Момент титрования, когда количество прибавленного титранта становится эквивалентным количеству определяемого вещества, называется эквивалентной точкой титрования или точкой эквивалентности. Ее определяют с помощью индикаторов или по изменению физико-химических характеристик титруемого раствора. Титриметрический анализ отличается быстротой и точностью полученных результатов. [9]
Титриметрический анализ ( титриметрия) является разделом количественного анализа, в котором количества веществ опреце-ляют путем точного измерения объема ( или массы) раствора реагента ( титранта), вступившего в химическую реакцию с определяемым веществом. Концентрация раствора реагента должна быть точно известна. Раствор реагента с точно известной концентрацией химически активного вещества называется стандартным раствором. Объем раствора реагента, пошедшего на реакцию, точно измеряют, для этого раствор реагента постепенно приливают из бюретки в исследуемый раствор - проводят титрование. Момент, когда реагент добавлен в исследуемый раствор в количестве, химически эквивалентном определяемому веществу ( избыток реагента в отличие от гравиметрии не берется), называется точкой эквивалентности, или теоретической точкой конца титрования. Для определения этого момента в исследуемый раствор добавляют вспомогательное вещество - индикатор. Практически изменение индикатора не точно совпадает с точкой эквивалентности, поэтому говорят о конечной точке титрования. Кроме индикаторных ( визуальных) методов определения точки эквивалентности существует ряд физико-химических, которые в настоящем пособии не рассматриваются. [10]
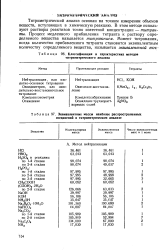 |
Эквивалентные массы наиболее распространенных соединений в титриметрическом анализе. [11] |
Титриметрический анализ основан на точном измерении объемов веществ, вступающих в химическую реакцию. В этом методе используют растворы реактивов точно известной концентрации - титран-ты. Процесс медленного прибавления титранта к раствору определяемого вещества называется титрованием. [12]
Титриметрический анализ является методом количественного анализа, в котором измеряют количество реактива, затраченного в ходе химической реакции. В титриметрическом анализе широко используют точное измерение объемов реагирующих веществ. В этом случае при определении, например, H2SO4 достаточно знать ее объем и объем и концентрацию щелочи. Реакция между кислотой и щелочью протекает мгновенно, окончание реакции фиксируется точно, поэтому измерения объемов и вычисления можно провести менее чем за 15 мин. Титриметрические методы дают большой выигрыш во времени, поэтому их так широко используют в химических лабораториях. [13]
Титриметрический анализ - это количественное определение компонента в исследуемом образце, осуществляемое точным измерением объемов веществ, вступающих в реакцию, концентрация одного из них обязательно должна быть точно известна. Раствор, содержание растворенного вещества в котором точно известно, называется стандартным раствором или титрантом. [14]
Титриметрический анализ основан на титровании, представляющем добавление раствора какого-либо химического вещества известной концентрации к раствору другого вещества неизвестной концентрации, но реагирующего с добавляемым веществом в эквивалентных количествах. По объему добавляемого раствора известной концентрации и объему титруемого раствора вычисляют концентрацию последнего. [15]
Страницы: 1 2 3 4