Заполнение - молекулярный орбиталь
Cтраница 2
Указанная последовательность определяет порядок заполнения молекулярных орбиталей, а именно, при образовании молекулы электроны располагаются на орбиталях с наиболее низкой энергией. [16]
Указанная последовательность определяет порядок заполнения молекулярных орбиталей, а именно, при образовании молекулы электроны располагаются на орбиталях с наиболее низкой энергией. [17]
 |
Заполнение молекулярных орбиталей в Н, ЬЬ, Не. [18] |
На рис. 46 показан порядок заполнения молекулярных орбиталей электронами при образовании молекул элементами II периода. В соответствии со схемами молекулы В2 и О2 - парамагнитны, а молекула Ве2 существовать не может. [19]
В табл. 10 показан порядок заполнения молекулярных орбиталей электронам. В соответствии со схемами, молскг ы DJ н Oj - - парамагнитны, а молекула Вса существовать не может. [20]
Начиная с бора, в двухатомных гомоядерных молекулах происходит заполнение молекулярных орбиталей, образованных из атомных р-орбиталей. Так как таких орбиталей две и они совершенно эквивалентны, то в соответствии с первым правилом Хунда электроны оказываются на разных орбиталях. Состояние со спином, равным 1, называется триплетным: ( три возможных состояния суммарного спина электрона) в отличие от синглетных состояний с единственным спиновым состоянием, отвечающим спину, равному нулю. [21]
Во всех случаях осуществляется именно та координация, которая приводит к заполнению молекулярных орбиталей 18 - ю электронами. В тригонально-бипирамидальном комплексе Fe ( CO) s восемь электронов дает железо, пять пар электронов дают карбонильные группы. В соединении с арсином две карбонильные группы заменяются на бидентатный донорный лиганд ( см. рис. 73); два атома As дают те же четыре электрона. Поэтому он заменяет только одну группу СО и координационное число металла повышается. [22]
Так же как существует порядок заполнения атомных орбиталей, существует и порядок заполнения молекулярных орбиталей. [23]
Из рассмотрения рассчитанных молекулярных орбит можно предполагать, что d - орбитали атомов фосфора и хлора принимают слабое участие в заполнении молекулярных орбиталей, но зато их участие ( особенно атомной орбиты атома хлора) в низших незаполненных орбитах более значительно. [24]
О приводит к сближению атомов молибдена ( до 2.569 А в цистиновом и до 2 541А - в оксалатном комплексах), что обеспечивает устойчивое 18-электронное заполнение молекулярных орбиталей каждого из двух атомов металла. [25]
Судя по присутствию в ИК-спектрах этих соединений двух полос в области 800 - 1000 см 1, комплексы [ WO2C14 ] 2 - так же как и MoO2Cl2 ( DMF) 2, имеют цис-строение, согласующееся с теоретическими представлениями о расположении двух л-донорных лигандов, осуществляющих три я-связи, необходимые для восемнадцатиэлектронного заполнения валентных молекулярных орбиталей октаэдрического комплекса. [26]
Система МО молекулы На используется для построения электронных конфигураций двухатомных гомонуклеарных молекул. Заполнение молекулярных орбиталей происходит в соответствии с принципом наименьшей энергии и принципом Паули, по два электрона размещаются на а - и по четыре на вырожденных я - и 8-орбиталях. Порядок, в котором возрастают энергии МО, устанавливается при исследовании молекулярных спектров и другими экспериментальными методами, а также при помощи квантовомеханических расчетов. [27]
Система МО молекулы Нг используется для построения электронных конфигураций двухатомных гомонуклеарных молекул. Заполнение молекулярных орбиталей происходит в соответствии с принципом наименьшей энергии и принципом Паули, по два электрона размещаются на о - и по четыре на вырожденных я - и В-орбиталях. Порядок, в котором возрастают энергии МО, устанавливается при исследовании молекулярных спектров и другими экспериментальными методами, а также при помощи квантовомеханических расчетов. [28]
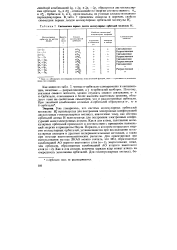 |
Систематика первых десяти молекулярных орбиталей молекулы Н. [29] |
Уже говорилось, что система молекулярных орбиталей молекулы HJ используется для построения электронных конфигураций двухатомных гомонуклеарных молекул, аналогично тому, как система орбиталей атома Н используется для построения электронных конфигураций многоэлектронных атомов. Как и для атома, заполнение молекулярных орбиталей происходит в соответствии с принципом наименьшей энергии и принципом Паули. Порядок, в котором возрастают энергии молекулярных орбиталей, устанавливается при исследовании молекулярных спектров и другими экспериментальными методами, а также при помощи квантовомеханических расчетов. Как и для атомов, величина зарядов ядер может влиять на очередность заполнения орбиталей. [30]
Страницы: 1 2 3