Заполнение - поверхность - электрод
Cтраница 3
Закономерности многостадийных процессов становятся также более сложными, если необходимо учитывать заполнение поверхности электрода исходными веществами, промежуточными или конечными продуктами реакции. [31]
И следовательно, и всего процесса в целом зависит от степени заполнения поверхности электрода адсорбированными частицами. [32]
Нам казалось, что при наличии замедленной электрохимической стадии увеличение степени заполнения поверхности электрода адсорбированными продуктами реакции должно вызвать рост перенапряжения на величину, близкую к равновесному потенциалу адсорбированного слоя, подобно тому, как это представляли А. Н. Фрумкин и Н. А. Аладжалова [6] в случае водородного перенапряжения на палладии. Учитывая приведенную выше зависимость роста перенапряжения от концентрации аниона, мы пришли к предположению о том, что увеличение окисления поверхности происходит при участии кислоты. [33]
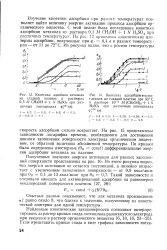
На рис. 15 представлены зависимости логарифма времени, необходимого для достижения данного заполнения поверхности электрода органическим веществом, от обратной величины абсолютной температуры. По кривым были определены изостерные ( 0R const) дифференциальные энергии адсорбции метанола на платине. [35]
Для равновесного адсо рбционно-десорбционного процесса адсорбцию вещества при заданной концентрации характеризует степень заполнения поверхности электрода молекулами или ионами адсорбата. [36]
В ехр ( - ДО / Г); 0 - степень заполнения поверхности электрода адсорбированными комплексами ( О Г / Г); а - аттракционная постоянная. [37]
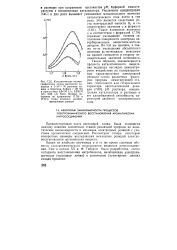
Такое изменение величины Y в соответствии с формулой (7.79) отражает уменьшение степени заполнения поверхности электрода адсорбированным веществом-катализатором. По той же причине, а также из-за уменьшения абсолютного значения - потенциала максимум на кривой смещается в сторону положительных значений потенциала. Таким образом, закономерности процесса каталитического выделения водорода наглядно демонстрируют воздействие на поляризационные характеристики электродной реакции самых различных факторов: природы лимитирующей стадии, гомогенного или гетерогенного характера протолитической реакции (7.69), рН раствора, концентрации катализатора в растворе и его адсорбционной способности, параметров двойного электрического слоя. [39]
Иногда высота анодной псевдопредволны отвечает меньшему, чем полное мономолекулярное покрытие, заполнению поверхности электрода адсорбированной пленкой. Природа этого эффекта еще не ясна. [40]
С увеличением плотности анодного тока и смещением потенциала в положительную сторону возрастает степень заполнения поверхности электрода окислом и толщина окисной пленки. При достижении критической анодной плотности тока поверхность электрода оказывается преимущественно закрытой окислом. Потенциал электрода при этом самопроизвольно смещается в область высоких положительных значений ( 1 - 7 в) и наступает анодная пассивность. [41]
В настоящее время накоплен обширный экспериментальный материал по кинетике электрохимических реакций в области высоких заполнений поверхности электрода ПАОВ. Однако для интерпретации кинетических закономерностей на электродах, практически полностью покрытых ПАОВ, разные авторы привлекают различные механизмы. [42]
Возрастание Ьк при переходе от 50 к 25 С, по-видимому, обусловлено увеличением степени заполнения поверхности электрода хло-ридными комплексами нульвалентной платины, которые тормозят скорость электроосаждения платины. [43]
Эти данные, полученные из гальваностатических кривых спада потенциала, свидетельствуют о том, что степени заполнения поверхности электрода адсорбированными ингибиторами велики. [44]
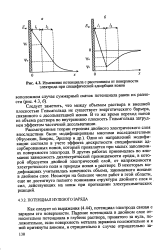 |
Изменение потенциала с расстоянием от поверхности электрода при специфической адсорбции ионов. [45] |
Страницы: 1 2 3 4