Заполнение - энергетические уровни
Cтраница 3
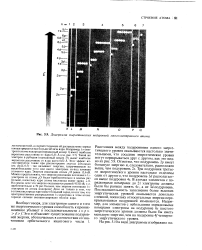 |
Диаграмма энергетических подуровней многоэлектронного атома. [31] |
В атомах элементов с порядковыми номерами до 21 электроны должны Ьыли бы раньше занять 4s -, а не 3 -подуровень Последовательность заполнения более высоких энергетических уровней оказывается довольно сложной, поскольку относительные энергии перекрывающихся подуровней изменяются Например, для элементов с небольшими порядковыми номерами электроны на подуровне 6s шестого энергетического уровня должны были бы иметь меньшую энергию, чем на подуровне 4 / четверто-го энергетического уровня. [32]
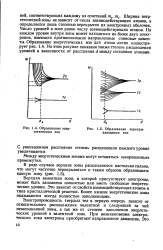 |
Образование энергетических зон.| Образование перекрывающихся зон. [33] |
Электропроводность твердых тел в первую очередь зависит от относительного расположения валентной и следующей за ней незаполненной зоны, а так же от степени заполнения энергетических уровней в валентной зоне. При возникновении электрического тока электроны приобретают направленное движение. [34]
Задача изложения основ современной неорганической химии не может быть решена путем простого увеличения удельного веса темы Строение вещества или выведения периодического закона из периодичности заполнения энергетических уровней в атоме. Обе эти тенденции обычно сопутствуют одна другой. [35]
Нам кажется, что на базе материала, излагаемого в курсе физики, в курсе химии средней школы должна быть приведена качественная картина характера заполнения энергетических уровней в атоме и на их основе описано строение системы элементов и даны представления о характере изменения ряда важнейших физических и химических свойств элементов. [36]
Специфика р-элементов четвертого - шестого периодов связана также с тем, что они отделены от s - элементов совокупностями элементов, в атомах которых происходит заполнение предшествующих энергетических уровней. [37]
Таким образом, резюмируя электронную квантовую интерпретацию периодического закона, следует признать, что не только качественно, но и количественно квантовая механика сумела объяснить порядок заполнения энергетических уровней электронов в атомах и образование оболочек или слоев, заполненных электронами. Как мы увидим далее, теория атомной периодической системы окажется весьма полезной при рассмотрении структуры атомных ядер. [38]
Если S -, р - и d - уровни в изолированных атомах какого-нибудь элемента близки, то в кристаллах соответствующие зоны перекрываются, а числа валентных электронов недостаточно - для заполнения энергетических уровней перекрывающихся зон. [39]
Номер элемента указывает, что в атоме 26 электронов. Заполнение энергетических уровней и подуровней ( атомных орбиталей) происходит в соответствии с принципом наименьшей энергии ( см. шкала энергии, стр. [40]
Здесь же заметим, что не следует представлять себе атомное ядро как статическую систему нуклонов, расположенных на дне потенциальной ямы. Заполнение энергетических уровней нуклонами ( фермионами) происходит в соответствии с принципом Паули. Основному состоянию ядра соответствует такое распределение нуклонов, при котором заполнены все низшие энергетические уровни. Если же какими-то воздействиями нуклоны ядра переводятся па более высокие незаполненные уровни, то это соответствует возбужденному состоянию ядра. [41]
 |
Схема возможного заполнения 2 / - орбиталей двумя электронами в атоме углерода. [42] |
Теперь можно построить электронную конфигурацию любого атома, В качестве примера рассмотрим атом натрия, содержащий 11 электронов. Последовательность заполнения энергетических уровней дана на с. У-ПОД уровень - оставшийся один электрон. [43]
Максимальная устойчивость атома ( как системы) соответствует минимуму его полной энергии. Последовательность заполнения энергетических уровней и подуровней в атоме электронами происходит в соответствии с принципом наименьшей энергии. [44]
Сложение спинов производится по правилу сложения векторов, так как спин электрона, определяющий величину собственного момента количества движения электрона, является вектором. Следовательно, заполнение энергетических уровней в атомах происходит таким образом, что при обычном состоянии атомов в первую очередь заполняются наиболее низкие энергетические уровни. [45]
Страницы: 1 2 3 4