Заполнение - электронные уровни
Cтраница 1
Заполнение электронных уровней осуществляется в соответствии с принципом наименьшей энергии: наиболее устойчивому состоянию электрона в атоме отвечает состояние с минимальным значением энергии. Поэтому вначале заполняются слои с наименьшими значениями энергии. Клечковский установил, что энергия электрона возрастает по мере увеличения суммы главного и орбитального квантовых чисел ( п /), поэтому заполнение электронных слоев происходит в порядке увеличения суммы главного и орбитального квантовых чисел. [1]
Заполнение электронных уровней атомов элементов VII периода аналогично таковому VI периода. Сколько элементов может находиться в VII периоде. [2]
Если до кальция заполнение электронных уровней шло в порядке возрастания номеров электронных оболочек ( Is, 2s, 2p, 3s, Зр, 4s), то после заполнения s - мест четвертой электронной оболочки вместо продолжения заполнения этой оболочки / - электронами начинается заполнение предыдущей, третьей, оболочки d - электронами. Всего в каждой оболочке может быть, как ясно из сказанного выше, 10 d - электронов. В рубидии и стронции, начинающих пятый период, появляются 5s - и 5з2 - элек-троны. [3]
Не раскрыв особенностей заполнения электронных уровней в атомах, конечно, нельзя раскрыть особенностей изменения свойств. [4]
На рис. 1.2.3 приведено заполнение электронных уровней атома углерода в основном состоянии. В атоме азота орбиталь 2р2 также заселена однократно, а начиная с атома кислорода и далее к фтору и неону, происходит двойное заселение 2р - АО. АО, что соответствует октету электронов и приводит к дополни -, тельной стабилизации. [5]
В этой последовательности должно происходить заполнение электронных уровней. Однако в металлах 4 - 6-го периодов ( от Sc до Ni, от V до Ра и от La до Pt и др.) заполнение электронами уровней 3d, Ы и 5d, 4f и 5f происходит только после того, как следующие за ними 4s, 5s и 6s уровни соответственно уже заполнены. Эти металлы с недостроенными d - или f - уровнями называются металлами переходных групп. Остальные металлы, имеющие полностью заполненные d - или f - уровни ( или со свободными d - уровнями для металлов малых атомных номеров), называются простыми. [6]
Таким образом, электронные формулы показывают, как осуществляется заполнение электронных уровней атомов. В этих формулах число впереди означает номер уровня, буквой выражается подуровень ( или тип орбитали), индекс справа вверху - число электронов в подуровне. Электронные формулы натрия и хлора запишутся так. [7]
Отсюда следует, что лимитирующая стадия процесса связана с изменением степени заполнения электронных уровней при добавлении примесей обоих видов. Кинетическое исследование, проведенное выше, показывает, что лимитирующей стадией является реакция адсорбированного кислорода с окисью углерода из газовой фазы. Согласно этой схеме, энергия активации должна, зависеть от особенностей процесса электронного обмена между кислородом и катализатором. [8]
Таким образом, электронные формулы кратко и весьма удобно показывают, как осуществляется заполнение электронных уровней атомов. В этих формулах число впереди означает номер уровня, буквой выражается подуровень ( или тип орбитали), индекс справа вверху - число электронов в подуровне. [9]
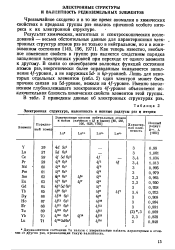 |
Электронная структура, валентность и ионные радиусы рзэ ц иттрия. [10] |
Как теперь известно, необычное изменение свойств в группе рзэ является следствием порядка заполнения электронных уровней при переходе от одного элемента к другому. В связи со своеобразием волновых функций состояния атомов рзэ, энергетически более оправданным оказывается заполнение 4 / - уровня, а не наружных5d - и бр-уровней. Лишь для некоторых отдельных элементов ( табл. 2) один электрон может быть прочнее связан на Jxf-уровне, нежели на 4 / - уровне. Именно заполнением глубоколежащего электронного 4 / - уровня объясняется исключительная близость химических свойств элементов этой группы. [11]
Их расположение в электронной конфигурации иона железа должно быть в согласии с только что изложенными основами заполнения электронных уровней. Хотя электронные пары находятся на разных уровнях, все же они энергетически равноценны и распределяются согласно правилу октетов. По терминологии квантовой механики, уровни, заполненные таким способом, называют гибридными. Электронные пары гибридных уровней обозначают большой буквой соответствующего уровня, а число пар электронов - в виде показателя. Первую из двух возможных электронных структур описывает выражение D28P3, вторую - SP3D2, причем принадлежность их к отдельным электронным оболочкам видна из порядка символов. В освобожденные таким образом два подуровня d могут затем войти электронные пары аддендов. [12]
Металлы и неметаллы в условиях химического взаимодействия стремятся приобрести электронную конфигурацию инертного элемента, при этом неметаллы стремятся присоединить недостающие для заполнения электронных уровней электроны, а металлы - отдать внешние, наименее связанные с ядром. Инертные элементы занимают промежуточное положение между металлами и неметаллами. [13]
Это означает, что нуклоны последовательно заполняют дискретные энергетические уровни, образующиеся в потенциальной яме ядра совершенно аналогично тому, как происходит заполнение электронных уровней в атоме. Так как электрический заряд разных нуклонов различен, протоны и нейтроны независимо последовательно заполняют свои энергетические уровни. На рис. 10.4 схематически изображены протонный и нейтронный потенциалы. [14]
Из рис. 43 и табл. 14 ясно, что в большинстве случаев заполнение зон в кристалле металла вследствие перекрывания уже не совпадает с последовательностью заполнения электронных уровней изолированных атомов. [15]
Страницы: 1 2