Заполнение - электронные уровни
Cтраница 2
 |
Расщепление iD - терма в полях различной симметрии. [16] |
Сх му расщепления для многоэлектронных атомов определяют, исходя из расщепления пятикратно вырожденного d - подуровня ( при октаэдрической симметрии до уровня tzg - с более низкой энергией и ее - с более высокой) и постепенного заполнения электронных уровней d - электронами. При этом рассматривают две возможности: случай слабого и сильного полей. В первом случае Д между / 2g и eg меньше энергии спаривания электронов, уровни заполняются последовательно: по одному электрону до половины ряда, затем - по второму электрону. Если А больше энергии спаривания электронов, последовательность заполнения изменяется: сначала полностью заселяется уровень с более низкой энергией, затем - с более высокой. [17]
Поскольку для серебра работа выхода W - 3J эв, то глубина потенциальной ямы в серебре оказывается равной 9 эв. Схема заполнения электронных уровней в металле изображена на фиг. [18]
 |
Перекрывание двух р-орбиталей, приводящее к образованию я-связи. [19] |
Электроны помещаются на уровне потенциального ящика последовательно, начиная с самого низшего, причем каждый уровень может максимально принять два электрона, которые в соответствии с принципом Паули должны различаться спинами. На рис. 2.5 справа указано такое заполнение электронных уровней для этилена в основном состоянии. [20]
Известно, что элекфоны в аюмс распределены но энер [ етическнм уровням. В этой же носледова гелыюсш должно происходи IB заполнение электронных уровней. Эти металлы с недостроенными d - или / - уровнями называются мешллами переходных гр пп. Остальные металлы, имеющие полностью заполненные d - или / - уровни ( или со свободными J-уровнямп для металлов малых атомных номеров), называются простыми. [21]
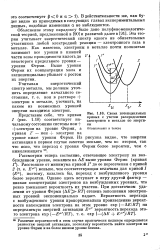 |
Схема потенциальных кривых с учетом распределения электронов в металле по энергиям. [22] |
Однако здесь вступает в игру другой фактор - низкая концентрация электронов на возбужденных уровнях, что резко уменьшает вероятность их участия. При достаточном удалении от уровня Ферми ( AE RT) степень заполнения электронных уровней экспоненциально падает. [23]
Итак, периодическая система Д. И. Менделеева является естественной классификацией химических элементов по электронной структуре их атомов. Об электронной структуре атома, а значит, и о свойствах элемента судят по положению элемента в соответствующем периоде и подгруппе периодической системы. Закономерностями заполнения электронных уровней объясняется различное число элементов в периодах. [24]
Итак, периодическая система Д.И.Менделеева является естественной классификацией химических элементов по электронной структуре их атомов. Об электронной структуре атома, а значит, и о свойствах элемента судят по положению момента в соответствующем периоде и подгруппе периодической системы. Закономерностями заполнения электронных уровней объясняется различное число элементов в периодах. [25]
Различают переходные и простые металлы. Известно, что электроны в атоме распределены по энергетическим уровням. В этой последовательности происходит заполнение электронных уровней. Однако в металлах 4 - 6-го периодов ( от Sc до Ni, от Y до Pd и от La до Pt) заполнение электронами уровней 3d, 4d и 5d происходит только после того, как следующие за ними 4s, 5s и 6s уровни соответственно уже заполнены. Эти металлы с недостроенными d - уровнями называются переходными. Остальные металлы, имеющие полностью заполненные d - уровни ( или с пустыми d - уровнями для металлов малых атомных номеров), называются простыми. [26]
Известно свыше 400 вариантов таблиц периодической системы, различающихся размещением отдельных групп элементов-аналогов, способом отображения периодического закона. В некоторых из них группа инертных газов размещена в правой части ( этими элементами заканчиваются периоды в системе), в других - в левой части ( ими начинаются периоды), в третьих - в середине таблицы. Есть таблицы, где элементы располагаются не в порядке заполнения электронных уровней в атомах, а в порядке последовательного расположения в левой части таблицы групп s - и р-элементов, в правой части - всех групп d - элементов, а затем / - элементов. Известны варианты, в которых элементы первого периода расположены внизу таблицы, а над ними элементы последующих периодов, что символизирует постепенное усложнение электронной оболочки атомов. Авторы ряда таблиц делят группы элементов на 3 или 4 подгруппы, внося в эти дополнительные подгруппы f - эле-менты. [27]
Бора относительно характера движения электрона в атоме в дальнейшем была отброшена. Тем не менее многое из работ Бора и других физиков, в основу которых были положены концепция Бора и его принцип соответствия, оказалось правильным. Концепция Бора не была отброшена в прямом смысле этого слова, просто ее стали понимать несколько иначе. Она была справедлива для разработанных Бором оболочечных структур различных химических элементов. Паули обнаружил, почему Бор приписал определенное число электронов различным оболочкам, ибо принцип запрета в применении к концепции Бора о строении атома накладывает ограничения на поведение электрона точно таким же образом, как это произвольно делал Бор, объясняя заполнение электронных уровней. [28]
Он совпадает со значением главного квантового числа, которым характеризуются заполняющиеся или завершенные внешние s - и р-оболочки. Периоды, в которых у атомов заполняются только эти оболочки, называются малыми. К ним относятся первые три периода, содержащие, соответственно, 2, 8, 8 элементов. Емкость третьего электронного слоя ( 18 электронов) превышает число элементов в третьем периоде. Это связано с существованием Sd-оболочки, которая остается вакантной у элементов 3-го периода, и ее заполнение становится энергетически выгодным только в четвертом периоде. Таким образом, начиная с 4-го периода нарушается порядок заполнения электронных уровней и между ns - и п / 5-элементами появляется вставная декада d - элемен-тов, у которых заполняется предвнешняя ( п - 1) с. Такой структурой обладают 4 - й и 5 - й периоды, содержащие по 18 элементов. Эти периоды должны состоять из 32 элементов. Периоды, содержащие кроме s - и р-элементов вставные декады d - элементов и семейства / - элементов, называются большими. В больших периодах у атомов заполняются не только внешние s - и / з-оболочки, но и пропущенные ранее, внутренние ( п - l) d - и ( п - 2) / - оболочки, которые также являются валентными. [29]
Страницы: 1 2