Заряд - катион - металл
Cтраница 1
Заряды катионов металла, перешедших в раствор, компенсируются зарядами анионов электролита, которые переносятся к поверхности электрода - в растворе появляется соль данного металла. Повышение концентрации катионов в приэлектродном слое вызывает диффузионный поток, направленный от поверхности металла в глубь раствора. В этом же направлении происходит перенос катионов, обусловленный наличием электрического поля между изучаемым анодом и вспомогательным катодом. Скорость этого процесса, выраженная через плотность анодного тока JA, составляет [ 3, стр. [1]
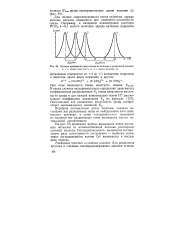 |
Кривые вымывания двух ионов из колонок с различной длиной. [2] |
Для сильно гидролизующихся ионов величина заряда катиона металла изменяется при изменении кислотности среды. [3]
При образовании внутрикомплексных соединений происходит нейтрализация заряда катиона металла и замещение молекул воды его гидратной оболочки на ионы органического реагента. В зависимости от состава комплекса, заряда катиона, его координационного числа в данном соединении, дентатности и основности реагента могут возникнуть, как легко видеть, соединения различного состава, различной зарядности, соединения гидратированные и лишенные координированных к металлу молекул воды. [4]
Как следует из определения, образование комплекса не всегда сопровождается насыщением заряда катиона металла. При присоединении нейтральных лигандов положительно заряженным центральным атомом металла образующийся комплекс имеет заряд, равный заряду исходного катиона. Такая реакция приводит к комплексному, или хелатному, катиону. Существуют также комплексные кислоты и основания. [5]
В таблице каждый ион металла представлен общим символом Мп, где п - заряд катиона металла. [6]
Опишите опыт, который следует провести для того, чтобы найти число единиц заряда катиона металла. [7]
Максимальное число присоединяющихся лигандов и зарядность образующихся комплексов определяются, как легко видеть, соотношением заряда катиона металла, его координационного числа, дентатностью реагента в данном соединении и числом солеобразующих групп в нем. Естественно, что при использовании полидентатных реагентов с различной основностью ( числом солеобразующих групп) могут возникать катионные, анионные и нейтральные комплексы. Полиядерные комплексы, которые могли быть нейтральными ( типа Ме3А4 и им подобные) образуются редко. [8]
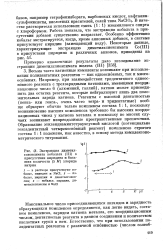 |
Экстракция диметилглиоксимата кобальта ( III в присутствии пиридина и больших количеств ( 5 М хлорида натрия. [9] |
Максимальное число присоединяющихся лигандов и зарядность образующихся комплексов определяются, как легко видеть, составом комплексов, зарядом катиона металла, его координационным числом, дентатностью реагента в данном соединении и количеством кислотных групп в нем. [10]
В общем случае реакция с мно-гоосновными реагентами может сопровождаться выделением более одного протона; в зависимости от состава комплекса и заряда катиона металла могут возникать соединения различной зарядности, в том числе анионные. [11]
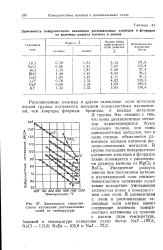 |
Зависимость поверхностного натяжения расплавленных солей от температуры. [12] |
Это связано с тем, что ионы двухвалентных металлов характеризуются более сильными полями, чем ионы одновалентных металлов, что в свою очередь объясняется удвоенным зарядом катионов ше-лочно-земельных металлов. Увеличение радиуса аниона при постоянном катионе в расплавленной соли снижает поверхностное натяжение солей также вследствие уменьшения количества ионов в поверхностном слое соли. [13]
Как следует из уравнения ( 8), графические зависимости IgD от рН и IgD от lg [ HA ] 0pr представляют собой прямые с наклоном, равным заряду катиона металла. [14]
При написании формул простых соединений ближайшую координационную сферу выделяют квадратными скобками, например [ Си ( ЫНзЫСЬ - Иоиы, расположенные за пределами ближайшей координационной сферы, образуют внешнюю координационную сферу. В зависимости от заряда катиона металла и лигаидов комплексы могут быть нейтральными или положительными, или отрицательно заряженными ионами. [15]
Страницы: 1 2