Заряд - металл
Cтраница 3
Количество избыточных зарядов в первом от чугуна ионном слое шлака определяется зарядом металла и специфической адсорбцией. Но межионные силы вызывают появление второго ионного слоя противоположного заряда. Аналогично могут появляться третий и следующие за ним слои. [31]
Толщина этого слоя в растворе зависит от концентрации рас твора, от заряда металла и от температуры. [32]
Уравнение ( Х-60) позволяет рассматривать потенциал электрода в ф-шкале как меру заряда металла ( интенсивности ионного двойного слоя 7ьм ( д) и как меру изменения ориентации полярных молекул растворителя на границе металл - электролит при переходе от нулевой точки к данному значению потенциала ( разность величин 7LM ( diPi) и W LMWZPO - Полагают, что ориентация диполей растворителя на незаряженной поверхности металла мало зависит от его природы и для всех металлов в водных растворах л - 7ьм ( dtpi) примерно одно и то же. [33]
В соответствии с развиваемыми взглядами, изменение направления реакции связано с изменением зарядов металла: при увеличении давления водорода и соответственно его адсорбции усиливаются электроноакцепторные свойства металла и его способность вытеснять прогон при образовании моноадсорбированного комплекса. В связи с этим с ростом давления водорода увеличивается доля молекул октана, реагирующих по протонному механизму; в реакцию вступают вторичные атомы углерода с последующим образованием дизамещенных циклов-1 - метил-2 - этилциклопентана и о-ксилола. [34]
 |
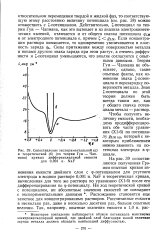
Строениь двойного электрического слоя металл - электролит. [35] |
Грэм предполагает далее, что емкость конденсированной части двойного электрического слоя зависит от заряда металла, но не от концентрации раствора. Это предположение в совокупности с допущениями, сделанными ранее, позволило Грэму предложить метод расчета кривых дифференциальной емкости для любых концентраций данного электролита, если имеется экспериментальная кривая хотя бы для одного его раствора. Основные этапы расчета сводятся к следующему. [36]
Уравнение ( X-60) позволяет рассматривать потенциал электрода в приведенной шкале как меру заряда металла ( интенсивности ионного двойного слоя gLM ( g)) и как меру изменения ориентации полярных молекул растворителя на границе металл - электролит при переходе от нулевой точки к данному значению потенциала ( разность величин gLM ( dipi) и wgLMCdipi)) - Имеются основания полагать, что ориентация диполей растворителя на незаряженной поверхности металла мало зависит от его природы, и для всех металлов в водных растворах jvgLM ( dipi) примерно одно и то же. [37]
 |
Строениь двойного электрического слоя металл - электролит. [38] |
Грэм предполагает далее, что емкость конденсированной части двойного электрического слоя зависит от заряда металла, но не от концентрации раствора. Это предположение в совокупности с допущениями, сделанными ранее, позволило Грэму предложить метод расчета кривых дифференциальной емкости для любых концентраций данного электролита, если имеется экспериментальная кривая хотя бы для одного его раствора. Основные этапы расчета сводятся к следующему. [39]
 |
Сопоставление экспериментальной ( а. [40] |
Некоторое совпадение наблюдается вблизи потенциала максимума электрокапиллярной кривой, где двойной слой благодаря малой величине заряда металла должен обладать наибольшей диффузностью. [41]
Нормальная составляющая электрического смещения в диэлектрике у поверхности металла в отсутствие тока равна поверхностной плотности заряда металла. [42]
Определить валентность металла и заменить водород кислоты металлом, после чего проверить, чтобы число положитель-ных зарядов металла и число отрицательных зарядов кислотных остатков было одинаково. [43]
Так как частные токи / а и / к одинаковы, то в условиях установившегося равновесия заряд металла по отношению к раствору, а следовательно, и потенциал электрода не являются функцией времени, а определяются лишь составом системы, ее температурой и давлением. Потенциал электрода е в этих условиях называется обратимым или равновесным электродным потенциалом. Величину равновесного электродного потенциала ( в условной шкале) можно вычислить при помощи общих термодинамических уравнений, если известны электродная реакция, активности участвующих в ней веществ, а также температура и давление. [44]
Так как частные токи / а и / к одинаковы, то в условиях установившегося равновесия заряд металла по отношению к раствору, а следовательно, и потенциал электрода не являются функцией времени; они определяются лишь составом системы, ее температурой и давлением. Потенциал электрода е в этих условиях называется обратимым или равновесным электродным потенциалом. Величину равновесного электродного потенциала ( в условной шкале) можно вычислить при помощи общих термодинамических уравнений, если только известны электродная реакция, активности участвующих в ней веществ, температура и давление. [45]
Страницы: 1 2 3 4